Recapitulando, as seguintes situações provocam diferenças de potencial eletroquímico que causam corrosão do ânodo:
a) Diferença de composição química;
b) Diferença de concentração de íons metálicos, no eletrólito;
c) Diferença de despolarização, devida à diferente concentração de oxigênio gasoso no elétrodo.
Não esgotamos, entretanto, todas as possibilidades.
É fácil ver que qualquer variação química que tenha 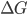 negativo, terá um potencial eletroquímico associado. Por exemplo, uma certa parte de uma peça de metal pode estar deformada plasticamente (1) e ter então energia livre mais alta, por unidade de volume, que o resto da peça. Conseqüentemente, a região deformada é anódica, e a região restante não-deformada é catódica. Analogamente, urn material finamente granulado é anódico em relação ao material com granulação grosseira. Diferenças nos níveis de tensão mecânica, mesmo na faixa elástica (2), também levam a diferenças de potencial. Portanto, incluiremos:
negativo, terá um potencial eletroquímico associado. Por exemplo, uma certa parte de uma peça de metal pode estar deformada plasticamente (1) e ter então energia livre mais alta, por unidade de volume, que o resto da peça. Conseqüentemente, a região deformada é anódica, e a região restante não-deformada é catódica. Analogamente, urn material finamente granulado é anódico em relação ao material com granulação grosseira. Diferenças nos níveis de tensão mecânica, mesmo na faixa elástica (2), também levam a diferenças de potencial. Portanto, incluiremos:
d) Diferencas de tensão, deformação plástica e imperfeições de microestrutura.
e) Ataque químico direto pelo meio ambiente.
Os resultados dessas situações enumeradas acima estão ao nosso redor (Veja Figura 19.f).
Figura 19.f – Detalhe de corrosão em tubo de alumínio(Al) fixado dentro de um tubo de aço 316.