Consideremos a célula mostrada na Fig. 19.b e a seguinte reação química:
 [19.1]
[19.1]
Se a variação de energia livre  para a reação acima for negativa,
para a reação acima for negativa,  (o ânodo) será ionizado, os elétrons resultantes irão, via fio elétrico, participar na redução de íons
(o ânodo) será ionizado, os elétrons resultantes irão, via fio elétrico, participar na redução de íons  . É a variação de energia livre
. É a variação de energia livre  que fornece o trabalho necessário para transferir os elétrons de
que fornece o trabalho necessário para transferir os elétrons de 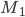 para
para 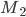 , isto é, aparece entre
, isto é, aparece entre 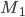 e
e 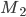 uma voltagem que depende da variação de energia livre. Se a célula for reversível, a variação de energia livre pode ser toda utilizada. É óbvio que, na reação 19.1, para cada mol de
uma voltagem que depende da variação de energia livre. Se a célula for reversível, a variação de energia livre pode ser toda utilizada. É óbvio que, na reação 19.1, para cada mol de  ionizado, n moles de elétrons são transferidos. Sabe-se que um mol de elétrons constitui uma carga de 96.500 coulombs. Este número é conhecido como Constante de Faraday, que é usualmente representada pela letra F.
ionizado, n moles de elétrons são transferidos. Sabe-se que um mol de elétrons constitui uma carga de 96.500 coulombs. Este número é conhecido como Constante de Faraday, que é usualmente representada pela letra F.
Conseqüentemente, numa célula reversível, a variação de energia livre e o trabalho elétrico podem ser igualados:
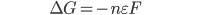 [19.2]
[19.2]
Na Equação 19.2, a variação de energia livre está em unidades de joules por mol, e a voltagem  de
de  e
e  está em volts. O sinal negativo foi colocado no segundo membro, de modo que a voltagem seja positiva, quando a variação de energia livre (
está em volts. O sinal negativo foi colocado no segundo membro, de modo que a voltagem seja positiva, quando a variação de energia livre (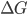 ) da Eq. 19.1 for negativa. Este é um procedimento (sinal negativo) convencional e pode variar de um país para outro.
) da Eq. 19.1 for negativa. Este é um procedimento (sinal negativo) convencional e pode variar de um país para outro.
Como veremos, é mais conveniente partir a reação da Equação 19.1 em duas reações de meia-célula:
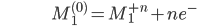
 [19.3a]
[19.3a]
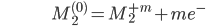
 [19.3b]
[19.3b]
Figura 19.b – Esquema de uma célula eletroquímica. Clique nos botões para visualizar.