Vidros são sólidos que se originaram de líquidos resfriados até a solidificação sem ordem atômica de longa distância (sólidos não-cristalinos). Por isso, os átomos no estado vítreo possuem arranjo similar aos átomos no estado líquido. Esse arranjo será muito próximo daquele que o líquido tinha imediatamente antes de atingir a faixa de temperaturas da transição vítrea (Tg). O diagrama volume-temperatura, apresentado na Figura 6.a, fornece informações qualitativas sobre as diferenças entre o sólido cristalino e o sólido não-cristalino. Os metais, por exemplo, se cristalizam facilmente quando submetidos a pequenos resfriamentos abaixo da temperatura de fusão, 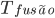 (linha vertical Tf na Figura 6.a). Os metais têm temperatura de fusão/solidificação bastante definidas, mas os líquidos formadores de vidro não possuem este ponto de fusão ou solidificação definido. Em muitos casos, líquidos formadores de vidros possuem alta viscosidade nas proximidades de
(linha vertical Tf na Figura 6.a). Os metais têm temperatura de fusão/solidificação bastante definidas, mas os líquidos formadores de vidro não possuem este ponto de fusão ou solidificação definido. Em muitos casos, líquidos formadores de vidros possuem alta viscosidade nas proximidades de  e não se solidificam logo abaixo desta temperatura. Por exemplo, o vidro de janela fundido a 1550
e não se solidificam logo abaixo desta temperatura. Por exemplo, o vidro de janela fundido a 1550 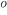 C é um líquido ~ 10.000 vezes mais viscoso do que a água a 20
C é um líquido ~ 10.000 vezes mais viscoso do que a água a 20  C. Como não se solidificou, o líquido “super-resfriado” reduzirá seu volume ao longo da linha, sendo o decréscimo de volume resultante da menor amplitude de vibração atômica e de relaxações estruturais mais restritas. À queda contínua da temperatura corresponde um aumento crescente da viscosidade. A 1.100
C. Como não se solidificou, o líquido “super-resfriado” reduzirá seu volume ao longo da linha, sendo o decréscimo de volume resultante da menor amplitude de vibração atômica e de relaxações estruturais mais restritas. À queda contínua da temperatura corresponde um aumento crescente da viscosidade. A 1.100 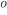 C, por exemplo, o vidro de janela é ~ 1.000.000 de vezes mais viscoso do que a água a 20
C, por exemplo, o vidro de janela é ~ 1.000.000 de vezes mais viscoso do que a água a 20  C. O movimento de translação das moléculas é cada vez mais difícil até que, na faixa da transição vítrea, ocorra uma mudança brusca no material e sejam bloqueados os movimentos de translação e rotação das moléculas. Este material rígido, cujas unidades estruturais não são mais capazes de se reorganizar como no líquido, é conhecido como vidro.
C. O movimento de translação das moléculas é cada vez mais difícil até que, na faixa da transição vítrea, ocorra uma mudança brusca no material e sejam bloqueados os movimentos de translação e rotação das moléculas. Este material rígido, cujas unidades estruturais não são mais capazes de se reorganizar como no líquido, é conhecido como vidro.
A temperatura onde ocorre o fenômeno descrito acima é chamada de temperatura de transição vítrea (Tg, “glass transition”) e não corresponde a um ponto definido, mas a uma faixa de valores de temperatura e depende da taxa de resfriamento utilizada. Se o resfriamento é muito lento, por exemplo, as reacomodações estruturais beneficiam-se do tempo mais longo e Tg estará mais próxima do canto esquerdo da faixa de transformação.
As estruturas dos sólidos não-cristalinos não são completamente aleatórias porque, na maioria deles, os átomos formam subunidades ordenadas. Isto é, existe ordem em curtas distâncias atômicas entre os primeiros vizinhos atômicos, mas não existe ordem de longa distância.
Por exemplo, o “carbono amorfo” foi assim chamado antes que a técnica de difração de raios-X mostrasse que sua estrutura era simplesmente constituída de folhas individuais semelhantes à grafita (ver Fig. 3.h, Capítulo 3), paralelas entre si, mas de orientações diferentes, isto é, existia ordem bidimensional, mas não tridimensional. Um diagrama de difração de raios-X (um difratograma) de pós cristalinos consiste de muitas linhas nítidas. Em contraste, um difratograma de um pó não-cristalino apresenta dois ou três halos indicando que a estrutura tem ordem de curto alcance, mas não de longo alcance. Em outras palavras, os átomos se arranjaram dentro das subunidades de modo ordenado e não aleatório, a ausência de ordem de longo alcance nos sólidos não-cristalinos é devida ao fato de que essas subunidades não se agregam de modo regular em três dimensões. A Figura 6.b mostra os difratogramas de raios-X de um mesmo material, a sílica ( ), no estado cristalino (quartzo, Figura 6.b.1) e no estado vítreo (sílica vítrea ou vidro de quartzo, Figura 6.b.2).
), no estado cristalino (quartzo, Figura 6.b.1) e no estado vítreo (sílica vítrea ou vidro de quartzo, Figura 6.b.2).
Fig 6.a – Mudanças de volume num líquido durante a solidificação. Um líquido pode solidificar-se como material cristalino com temperatura de fusão 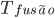 definida, ou como material vítreo sem uma temperatura de fusão definida e que apresenta a transição vítrea (Tg).
definida, ou como material vítreo sem uma temperatura de fusão definida e que apresenta a transição vítrea (Tg).
Figura 6.b – Difratograma de raios-X da sílica(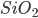 ) no (1) estado cristalino(quartzo) e (2) vidro de quartzo (sílica vítrea).
) no (1) estado cristalino(quartzo) e (2) vidro de quartzo (sílica vítrea).