A maioria das redes tridimensionais são vidros inorgânicos, especialmente óxidos. O vidro de janela é um deles. Do mesmo modo que, para os polímeros de cadeias longas, qualquer tipo de arranjo frouxo – resultado de uma agregação pouco compacta dos constituintes da rede – favorecerá a formação de estruturas não-cristalinas. A densidade (massa atômica/volume ocupado pelos átomos) destes arranjos é sempre menor do que dos arranjos cristalinos. Naturalmente, as razões para existirem estruturas abertas nos compostos inorgânicos, como óxidos, são diferentes daquelas que se aplicam aos polímeros, porque as subunidades são muito diferentes. Nos óxidos, as estruturas abertas são usualmente devidas a uma forte repulsão cátion-cátion, que é mais pronunciada quando os poliedros de coordenação são pequenos e a carga do cátion é elevada 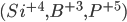 .
.
Zachariasen (1) propôs as seguintes regras para que um composto inorgânico tenha propensão para ser não-cristalino no estado sólido :
1. cada ânion é ligado a apenas dois cátions;
2. o número de ânions que rodeia um cátion deve ser pequeno (3 ou 4);
3. os poliedros aniônicos compartilham vértices, mas não arestas ou faces;
4. pelo menos três vértices do poliedro devem ser compartilhados.
Por exemplo, a sílica,  (
( coordenado tetraedricamente pelo oxigênio, Figura 6.e) e o óxido de boro,
coordenado tetraedricamente pelo oxigênio, Figura 6.e) e o óxido de boro, 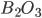 (
(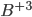 coordenado triangularmente pelo oxigênio, Figura 6.f) formam vidros facilmente. Em ambas as estruturas, a carga catiônica é alta e os poliedros aniônicos são pequenos, resultando em estruturas muito abertas. Por outro lado, o óxido de magnésio MgO (
coordenado triangularmente pelo oxigênio, Figura 6.f) formam vidros facilmente. Em ambas as estruturas, a carga catiônica é alta e os poliedros aniônicos são pequenos, resultando em estruturas muito abertas. Por outro lado, o óxido de magnésio MgO (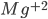 ,coordenado octaedricamente pelo oxigênio, Figura 6.g) não forma vidro; os poliedros de coordenação compartilham entre si arestas numa estrutura cristalina relativamente compacta.
,coordenado octaedricamente pelo oxigênio, Figura 6.g) não forma vidro; os poliedros de coordenação compartilham entre si arestas numa estrutura cristalina relativamente compacta.
A maioria dos vidros inorgânicos tem como base a sílica 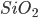 , e então a subunidade fundamental é o tetraedro Si-0 (Figura 6.e; veja também Cap. 2). No vidro de sílica pura, esses tetraedros estão unidos vértice a vértice mas não apresentam ordem de longo alcance, como no quartzo ou na cristobalita (ver Cap. 3, Figura 3.p.). Na Fig. 6.c, representa-se a estrutura local de um vidro de quartzo (sílica vítrea) com átomos de silício e oxigênio formando os tetraedros de sílica. No
, e então a subunidade fundamental é o tetraedro Si-0 (Figura 6.e; veja também Cap. 2). No vidro de sílica pura, esses tetraedros estão unidos vértice a vértice mas não apresentam ordem de longo alcance, como no quartzo ou na cristobalita (ver Cap. 3, Figura 3.p.). Na Fig. 6.c, representa-se a estrutura local de um vidro de quartzo (sílica vítrea) com átomos de silício e oxigênio formando os tetraedros de sílica. No 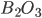 , as unidades são triângulos (na realidade, pirâmides muito chatas, pois o átomo de boro está ligeiramente fora do plano dos átomos de oxigênio), que são também unidos vértice a vértice, numa configuração aleatória.
, as unidades são triângulos (na realidade, pirâmides muito chatas, pois o átomo de boro está ligeiramente fora do plano dos átomos de oxigênio), que são também unidos vértice a vértice, numa configuração aleatória.
Compostos como o fluoreto de berílio (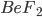 ), sulfeto de germânio (
), sulfeto de germânio (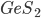 ) e sulfato de arsênio (
) e sulfato de arsênio ( ) formam vidros não-óxidos e também têm suas subunidades arranjadas aleatoriamente. Os elementos enxofre (S,
) formam vidros não-óxidos e também têm suas subunidades arranjadas aleatoriamente. Os elementos enxofre (S, 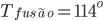 C) e selênio (Se,
C) e selênio (Se, 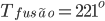 C) são exemplos de que uma estrutura não-cristalina pode ser obtida pelo resfriamento brusco de um líquido viscoso até a temperatura ambiente. Ambos os elementos estão na coluna VI da Tabela Periódica (Veja na lista de capítulos). Em ambos, a ligação é covalente, devido à superposição dos orbitais p (veja Capítulo 1). Este tipo de ligação química produz longas cadeias moleculares desses átomos, semelhantes às do telúrio (Te) (Capítulo 3, Fig 3.e). No enxofre e no selênio, essas cadeias moleculares são emaranhadas no estado líquido e desenvolvem uma estrutura não-cristalina ao se resfriar rapidamente o material. No chamado enxofre fibroso, as moléculas de enxofre de cadeia longa estão realmente misturadas com moléculas em forma de anel (S8, oito átomos de enxofre). Assim, um tipo de molécula impede que a outra cristalize. Os elementos telúrio (Te) e polônio (Po), colocados mais abaixo na mesma coluna VI, formam somente sólidos cristalinos quando resfriados à temperatura ambiente, presumivelmente porque a ligação é mais metálica (elétrons estão ligados menos firmemente ao núcleo), e os átomos e moléculas possuem maior mobilidade. Em geral, quanto mais difusa (metálica) a ligação e mais compacta a estrutura cristalina de um elemento, mais difícil é obtê-lo no estado vítreo.
C) são exemplos de que uma estrutura não-cristalina pode ser obtida pelo resfriamento brusco de um líquido viscoso até a temperatura ambiente. Ambos os elementos estão na coluna VI da Tabela Periódica (Veja na lista de capítulos). Em ambos, a ligação é covalente, devido à superposição dos orbitais p (veja Capítulo 1). Este tipo de ligação química produz longas cadeias moleculares desses átomos, semelhantes às do telúrio (Te) (Capítulo 3, Fig 3.e). No enxofre e no selênio, essas cadeias moleculares são emaranhadas no estado líquido e desenvolvem uma estrutura não-cristalina ao se resfriar rapidamente o material. No chamado enxofre fibroso, as moléculas de enxofre de cadeia longa estão realmente misturadas com moléculas em forma de anel (S8, oito átomos de enxofre). Assim, um tipo de molécula impede que a outra cristalize. Os elementos telúrio (Te) e polônio (Po), colocados mais abaixo na mesma coluna VI, formam somente sólidos cristalinos quando resfriados à temperatura ambiente, presumivelmente porque a ligação é mais metálica (elétrons estão ligados menos firmemente ao núcleo), e os átomos e moléculas possuem maior mobilidade. Em geral, quanto mais difusa (metálica) a ligação e mais compacta a estrutura cristalina de um elemento, mais difícil é obtê-lo no estado vítreo.
Fig. 6.e – Tetraedro de sílica (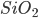 );
);
Fig. 6.f – Estrutura do óxido boro vítreo ( );
);
Fig. 6.g – Estrutura da magnésia (óxido de magnésio) MgO cristalina.