Nas Figuras 3.n e 3.o mostram-se as diferenças entre representações dos empilhamentos CFC e HC por meio de arranjos de esferas e por meio de arranjos de tetraedros e octaedros.
Num cristal iônico (1) , os vértices representam posições aniônicas e os centros dos tetraedros e octaedros representam posições de cátions. Num cristal verdadeiramente iônico, é a razão dos raios iônicos que determina se as posições tetraédricas e octaédricas estarão ocupadas: a coordenação tetraédrica é estável para 0,225 < 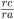 < 0,414 e a octaédrica é estável para 0,414 <
< 0,414 e a octaédrica é estável para 0,414 <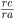 <0,732. A fração de posições catiônicas disponíveis que serão ocupadas depende apenas da fórmula química, pois há números fixos de cada tipo de posição. A geometria do empilhamento, nesses arranjos, é tal que há iguais números de posições compactas aniônicas, posições catiônicas octaédricas, posições catiônicas tetraédricas, de vértice “para cima”, e posições catiônicas tetraédricas, “invertidas”. Algumas das estruturas cristalinas mais comuns de compostos binários, que se enquadram no modelo geométrico descrito, apresentam-se na Tabela 3.1.
Nos compostos que formam cristais verdadeiramente iônicos, o arranjo dos cátions que ocupam somente uma fração de um tipo de posições é aquele que maximiza a distância média cátion - cátion. Para os cristais nos quais a ligação não é completamente iônica, como no arseneto de níquel(NiAs)(2), a natureza covalente ou metálica das ligações pode determinar os arranjos dos cátions.
<0,732. A fração de posições catiônicas disponíveis que serão ocupadas depende apenas da fórmula química, pois há números fixos de cada tipo de posição. A geometria do empilhamento, nesses arranjos, é tal que há iguais números de posições compactas aniônicas, posições catiônicas octaédricas, posições catiônicas tetraédricas, de vértice “para cima”, e posições catiônicas tetraédricas, “invertidas”. Algumas das estruturas cristalinas mais comuns de compostos binários, que se enquadram no modelo geométrico descrito, apresentam-se na Tabela 3.1.
Nos compostos que formam cristais verdadeiramente iônicos, o arranjo dos cátions que ocupam somente uma fração de um tipo de posições é aquele que maximiza a distância média cátion - cátion. Para os cristais nos quais a ligação não é completamente iônica, como no arseneto de níquel(NiAs)(2), a natureza covalente ou metálica das ligações pode determinar os arranjos dos cátions.
Figura 3.n. Animação mostrando uma célula unitária cúbica, recortada, de um arranjo CFC de esferas. Indica-se somente a porção de cada esfera que se encontra realmente dentro da célula unitária. Ou a mesma célula unitária representada por figuras geométricas que resultam de se conectarem por linhas retas os centros de esferas vizinhas (mude de esfera para ponto na barra lateral). As figuras são tetraedros e octaedros. Outros octaedros encaixam-se ao longo das arestas da célula unitária cúbica. Note-se que esta representação faz realçar a coordenação das posições intersticiais num arranjo compacto.
Figura 3.o. (a) Uma célula unitária hexagonal, recortada, de um arranjo HC de esferas. Indica-se somente a posição de cada esfera que se encontra realmente dentro da célula unitária. (b) A célula unitária de (a), representada por figuras geométricas que resultam de se conectarem por linhas retas os centros de esferas vizinhas. As figuras são tetraedros e octaedros. Outros octaedros e tetraedros (não representados) encaixam-se ao longo das arestas da célula unitária. Compare o empilhamento de poliedros nesta figura com o empilhamento mostrado na Figura 3.n.
Tabela 3.1. Exemplos de estruturas cristalinas descritas como arranjos compactos de ânions.