Embora muito poucos cristais sejam completamente iônicos, muitos têm uma proporção significativa de ligação iônica e podem ser classificados, em sentido amplo, como cristais iônicos. NaCI, MgO,  , e LiF são alguns exemplos. Nos cristais puramente iônicos, os poliedros aniônicos são arranjados de modo a manter neutralidade elétrica e minimizar a energia de ligação por unidade de volume, sem induzir qualquer repulsão forte entre íons de mesmo sinal. A repulsão é maior entre os cátions porque sua carga está concentrada num menor volume e então os poliedros devem ser empilhados de modo que os cátions, nos centros, estejam o mais afastados possível uns dos outros, de modo que a repulsão seja desprezível. Pequenos poliedros de coordenação (triângulos e tetraedros) em torno de cátions altamente carregados usualmente compartilham entre si apenas seus vértices, maximizando assim a distância entre cátions. É menos comum que compartilhem arestas e nunca são empilhados face a face. À medida que o número de coordenação cresce e a carga do cátion decresce, os poliedros aniônicos podem ser empilhados mais compactamente, isto é, podem compartilhar arestas ou mesmo faces, sem que os cátions se aproximem muito uns dos outros. Os arranjos dos poliedros de coordenação de algumas estruturas cristalinas mais representativas, descritos abaixo, ilustram esses pontos.
, e LiF são alguns exemplos. Nos cristais puramente iônicos, os poliedros aniônicos são arranjados de modo a manter neutralidade elétrica e minimizar a energia de ligação por unidade de volume, sem induzir qualquer repulsão forte entre íons de mesmo sinal. A repulsão é maior entre os cátions porque sua carga está concentrada num menor volume e então os poliedros devem ser empilhados de modo que os cátions, nos centros, estejam o mais afastados possível uns dos outros, de modo que a repulsão seja desprezível. Pequenos poliedros de coordenação (triângulos e tetraedros) em torno de cátions altamente carregados usualmente compartilham entre si apenas seus vértices, maximizando assim a distância entre cátions. É menos comum que compartilhem arestas e nunca são empilhados face a face. À medida que o número de coordenação cresce e a carga do cátion decresce, os poliedros aniônicos podem ser empilhados mais compactamente, isto é, podem compartilhar arestas ou mesmo faces, sem que os cátions se aproximem muito uns dos outros. Os arranjos dos poliedros de coordenação de algumas estruturas cristalinas mais representativas, descritos abaixo, ilustram esses pontos.
Coordenação triangular é observada raramente em sólidos iônicos, porque requer grande diferença de tamanhos dos íons. Um exemplo é o óxido de boro,  , mas ele é encontrado como sólido amorfo (não-cristalino). Os poliedros são triângulos e compartilham somente os vértices; mas, a proximidade mútua dos íons de boro e a dificuldade de construir-se uma estrutura tridimensional estável a partir de triângulos unidos pelos vértices, explicam provavelmente por que o composto é usualmente não-cristalino (Figura 3.l) (veja Cap. 5, sólido não-cristalino).
, mas ele é encontrado como sólido amorfo (não-cristalino). Os poliedros são triângulos e compartilham somente os vértices; mas, a proximidade mútua dos íons de boro e a dificuldade de construir-se uma estrutura tridimensional estável a partir de triângulos unidos pelos vértices, explicam provavelmente por que o composto é usualmente não-cristalino (Figura 3.l) (veja Cap. 5, sólido não-cristalino).
Estruturas cristalinas que contêm cátions coordenados tetraédrica ou octaedricamente e que não são fortemente carregados, podem também ser discutidas dentro do mesmo ponto de vista geométrico.
Se os cátions não são altamente carregados, os poliedros aniônicos podem ser empilhados o mais compactamente possível, para minimizar a energia por unidade de volume; e um arranjo repetitivo, compacto, de tetraedros, contém espaços octaédricos entre os tetraedros. Do mesmo modo, um arranjo repetitivo, compacto, de octaedros, contém espaços vazios tetraedricos. Isto é um outro modo de dizer que nem os tetraedros, regulares, nem os octaedros regulares, sozinhos, podem preencher completamente o espaço, mas uma combinação dos dois o fará. Então, consideraremos os dois, conjuntamente. Cristalograficamente, esta combinação de tetraedros e octaedros corresponde a colocar ânions nas posições atômicas da estrutura CFC ou HC, ficando os cátions nas posições entre eles, coordenada tetraedrica ou octaedricamente.
A Figura 3.m mostra cada tipo dessas posições, entre dois planos compactos formados por esferas. Se, na figura, os centros de todas as esferas vizinhas forem conectados por linhas retas, o resultado será uma camada de tetraedros e octaedros, empilhados face a face. Adicionar um terceiro plano de esferas corresponde a adicionar outra camada de tetraedros e octaedros. Se tetraedros são empilhados sobre tetraedros, e octaedros sobre octaedros (se os poliedros semelhantes tiverem faces em comum), o empilhamento das esferas, representando as posições dos ânions, é HC. Se tetraedros são empilhados sobre octaedros e vice-versa (se faces semelhantes tiverem em comum apenas arestas), o arranjo das esferas é CFC.
Figura 3.l – Coordenação triangular no óxido bórico (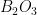 ).
).
Figura 3.m- Um plano compacto de esferas colocado sobre outro. Indicam-se uma posição tetraédrica intersticial e uma posição octaédrica intersticial.