Alotropia é o nome dado ao fenômeno de um elemento químico existir em dois ou mais arranjos tridimensionais. O exemplo mais comum são as várias formas alotrópicas do carbono (diamante, grafita e fulerenos são as mais conhecidas).
A grafita é uma dessas formas cristalina do carbono; nela os átomos são ligados covalentemente em arranjos planares hexagonais, com fracas ligações secundárias entre os planos (Figura 3.h).
Supõe-se, neste caso, que as ligações primárias covalentes ocorrem entre os orbitais 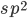 ; as ligações mais fracas, entre os planos, têm características de ligação metálica. O resultado é que a grafita conduz eletricidade e calor paralelamente aos planos muito mais facilmente do que na direção perpendicular a eles.
; as ligações mais fracas, entre os planos, têm características de ligação metálica. O resultado é que a grafita conduz eletricidade e calor paralelamente aos planos muito mais facilmente do que na direção perpendicular a eles.
O estanho (Sn) também possui duas formas alotrópicas. No estanho branco (metálico), a ligação é também um misto de metálica e covalente e a estrutura cristalina é tetragonal de corpo centrado, com dois átomos por ponto da rede. A outra forma é o estanho cinza ou estanho alfa e que ocorre abaixo de 13,2 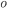 C. O estanho alfa possui estrutura cristalina cúbica e é um semicondutor. Por outro lado, o chumbo (Pb) tem estrutura cristalina tipicamente metálica (CFC).
C. O estanho alfa possui estrutura cristalina cúbica e é um semicondutor. Por outro lado, o chumbo (Pb) tem estrutura cristalina tipicamente metálica (CFC).
Figura 3.h A estrutura cristalina da grafita, mostrando as camadas hexagonais de átomos de carbono. As posições atômicas são representadas por esferas e as ligações direcionais por hastes entre esferas. Cada esfera se liga a três outros átomos (coordenação tripla).