As forças envolvidas na adsorção de gases e vapores por sólidos podem ser ligações não específicas e não-direcionais (van der Waals-London), que são ligações similares àquelas que resultam na liquefação. Este processo é chamado de Fisisorção. A Fisisorção pode levar à formação de ligações químicas entre o substrato e o gás. Neste caso o processo é chamado de Quimissorção.
A adsorção física de gases é usualmente rápida. Como não é necessário nenhuma energia adicional para que o processo ocorra, a adsorção física de gases é quase sempre reversível. O aquecimento do substrato, por exemplo, leva à dessorção do gás. A adsorção física forma multicamadas no substrato e, quando existe saturação de vapor, a adsorção física ocorre concomitantemente à liquefação.
Na quimissorção apenas monocamadas moleculares são formadas. A quimissorção é um processo específico que exige uma energia de ativação (1) para ocorrer. Inicialmente, a molécula 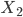 deve estar fisicamente fixada no substrato. A etapa seguinte é a quimissorção, que exige energia para ocorrer e resulta na dissociação da molécula em dois átomos (2X) que se ligam ao substrato. O processo varia de sistema para sistema. A Figura 12.l apresenta um diagrama qualitativo das energias potenciais de interação envolvidas na quimissorção e fisisorção em função da distância das moléculas
deve estar fisicamente fixada no substrato. A etapa seguinte é a quimissorção, que exige energia para ocorrer e resulta na dissociação da molécula em dois átomos (2X) que se ligam ao substrato. O processo varia de sistema para sistema. A Figura 12.l apresenta um diagrama qualitativo das energias potenciais de interação envolvidas na quimissorção e fisisorção em função da distância das moléculas  até o substrato. As moléculas
até o substrato. As moléculas  não possuem atração nenhuma para muitas distâncias muito maiores do que o tamanho da molécula, porisso a curva F toca a abcissa para distâncias maiores entre
não possuem atração nenhuma para muitas distâncias muito maiores do que o tamanho da molécula, porisso a curva F toca a abcissa para distâncias maiores entre 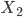 e o substrato. Quando a aproximação entre molécula e substrato é da ordem do diâmetro atômico, surgem forças atrativas de van der Waals-London. Depois deste mínimo, uma aproximação maior implicará em surgimento de repulsão entre nuvens eletrônicas. Esta atração é de pequena magnitude (chamada de Calor de Fisisorção) se comparada ao Calor de Quimissorção (Curva Q). A energia necessária para dissociar a
e o substrato. Quando a aproximação entre molécula e substrato é da ordem do diâmetro atômico, surgem forças atrativas de van der Waals-London. Depois deste mínimo, uma aproximação maior implicará em surgimento de repulsão entre nuvens eletrônicas. Esta atração é de pequena magnitude (chamada de Calor de Fisisorção) se comparada ao Calor de Quimissorção (Curva Q). A energia necessária para dissociar a 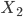 é apresentada para longas distâncias entre moléculas e substrato. Quando a molécula se aproxima do sólido, ela, inteira, é fisicamente adsorvida. Isto reduz o potencial positivo de interação até que, no ponto onde as duas curvas se cruzam, inicia-se a transição para a dissociação da molécula
é apresentada para longas distâncias entre moléculas e substrato. Quando a molécula se aproxima do sólido, ela, inteira, é fisicamente adsorvida. Isto reduz o potencial positivo de interação até que, no ponto onde as duas curvas se cruzam, inicia-se a transição para a dissociação da molécula  para dois átomos X, ambos individualmente ligados quimicamente à superfície. Para um dado sistema, o Calor de Quimissorção é muito maior do que o de Fisisorção. Repare também que a distância entre substrato e átomos é menor na quimissorção do que na fisisorção, pois no primeiro caso a molécula foi desmontada em átomos individuais que realizam ligações de tipo covalente ou iônico com o substrato.
para dois átomos X, ambos individualmente ligados quimicamente à superfície. Para um dado sistema, o Calor de Quimissorção é muito maior do que o de Fisisorção. Repare também que a distância entre substrato e átomos é menor na quimissorção do que na fisisorção, pois no primeiro caso a molécula foi desmontada em átomos individuais que realizam ligações de tipo covalente ou iônico com o substrato.
Um problema tecnológico importante é, por exemplo, a quimissorção do gás 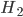 (hidrogênio) pelos metais.
(hidrogênio) pelos metais.
Figura 12.l – Diagrama das energias potenciais de fisisorção e quimissorção.