As ligações do benzeno  são comumente representadas como mostra a Figura 1.i.a. Entretanto, todos os comprimentos das ligações carbono-carbono nesta molécula são iguais e valem ~0,139nm. Este valor é maior do que o comprimento da ligação dupla C=C (0,134 nm), mas menor do que o valor da ligação simples C-C (0,154 nm). Uma representação mais comum da molécula do benzeno é mostrada na Figura 1.i.b, onde a molécula é considerada como ressonante ou, em outras palavras, rapidamente alternando entre as estruturas (a) e (b). A ligação real é, na verdade, uma estrutura híbrida ressonante, como mostrada na animação da Figura 1.i: as nuvens eletrônicas do orbital p fundem-se e formam anéis acima e abaixo (1) do anel de benzeno. Os cinco elétrons formam orbitais
são comumente representadas como mostra a Figura 1.i.a. Entretanto, todos os comprimentos das ligações carbono-carbono nesta molécula são iguais e valem ~0,139nm. Este valor é maior do que o comprimento da ligação dupla C=C (0,134 nm), mas menor do que o valor da ligação simples C-C (0,154 nm). Uma representação mais comum da molécula do benzeno é mostrada na Figura 1.i.b, onde a molécula é considerada como ressonante ou, em outras palavras, rapidamente alternando entre as estruturas (a) e (b). A ligação real é, na verdade, uma estrutura híbrida ressonante, como mostrada na animação da Figura 1.i: as nuvens eletrônicas do orbital p fundem-se e formam anéis acima e abaixo (1) do anel de benzeno. Os cinco elétrons formam orbitais  , pertencem à molécula
, pertencem à molécula  e não ficam confinados à ligação entre dois átomos. A fórmula química que expressa esse conceito de ressonância para o anel de benzeno é apresentada na Figura 6.i.c.
e não ficam confinados à ligação entre dois átomos. A fórmula química que expressa esse conceito de ressonância para o anel de benzeno é apresentada na Figura 6.i.c.
Considera-se que a ressonância é um fenônemo que confere estabilidade adicional à molécula. O conceito de ressonância é importante para se avaliar o comportamento de moléculas polares como o HCl e o HF, onde a ressonância entre ligações de tipo covalente e iônico poderia ocorrer.
De fato, uma conseqüência do conceito de ressonância é a conclusão de que não existem limites precisos que separem claramente uma ligação covalente de uma iônica. A transição de um tipo de ligação para o outro seria um processo contínuo.
Figura 1.i. – As fórmulas químicas para o anel de benzeno 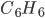 e os orbitais
e os orbitais  que resultam da formação de anéis pelos elétrons de valência (orbital p), acima e abaixo, do anel formado pelos caroços iônicos (2) dos átomos de carbono.
que resultam da formação de anéis pelos elétrons de valência (orbital p), acima e abaixo, do anel formado pelos caroços iônicos (2) dos átomos de carbono.