Enquanto as ligações das moléculas de  ,
, 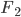 ou
ou  são consideradas puramente covalentes, as ligações das moléculas HF,
são consideradas puramente covalentes, as ligações das moléculas HF, 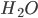 ,
,  ou
ou  possuem considerável grau de ionicidade, devido a assimetrias na densidade eletrônica entre os átomos que compõem a molécula. Estas assimetrias associadas às diferenças de tamanho entre os átomos participantes na construção da molécula levam ao surgimento de moléculas polares, como é o caso da molécula de HF, onde os centros de carga positiva e negativa, ao não coincidirem, formam um dipolo. A molécula da água (
possuem considerável grau de ionicidade, devido a assimetrias na densidade eletrônica entre os átomos que compõem a molécula. Estas assimetrias associadas às diferenças de tamanho entre os átomos participantes na construção da molécula levam ao surgimento de moléculas polares, como é o caso da molécula de HF, onde os centros de carga positiva e negativa, ao não coincidirem, formam um dipolo. A molécula da água (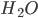 ) é polar e não-linear com ângulo médio de
) é polar e não-linear com ângulo médio de  formado entre as duas ligações O-H (Veja Figura 1.g). O ângulo é de
formado entre as duas ligações O-H (Veja Figura 1.g). O ângulo é de  ao invés de
ao invés de  entre os orbitais 2p do oxigênio e pode ser devido à repulsão entre as nuvens eletrônicas das ligações O-H. A molécula da amônia (
entre os orbitais 2p do oxigênio e pode ser devido à repulsão entre as nuvens eletrônicas das ligações O-H. A molécula da amônia (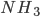 ), também polar, possui uma estrutura piramidal com um ângulo médio de
), também polar, possui uma estrutura piramidal com um ângulo médio de  entre as ligações N-H.
entre as ligações N-H.
A Tabela 1.4 apresenta os valores de ponto de fusão e momento do dipolo molecular para compostos que possuem o mesmo número de elétrons do neônio.
Tabela 1.4. Valores de ponto de fusão e momento do dipolo molecular para compostos que possuem o mesmo número de elétrons do neônio.

Nem sempre podemos supor que a população orbital de um átomo livre seja a mesma de um átomo ligado. Por exemplo, o carbono (C), cuja configuração eletrônica é 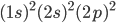 , forma algumas vezes quatro ligações covalentes de igual valor (tanto na metana,
, forma algumas vezes quatro ligações covalentes de igual valor (tanto na metana, 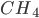 , como no diamante); este arranjo seria impossível com apenas dois orbitais semipreenchidos.
, como no diamante); este arranjo seria impossível com apenas dois orbitais semipreenchidos.
Figura 1.g – A molécula da água 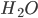 .
.