A presença de outro átomo distorce o formato geométrico da curva de densidade de probabilidade do primeiro porque há uma tendência para os elétrons passarem um pouco mais de tempo entre os núcleos. A ligação é covalente quando ambos os elétrons estão entre os núcleos, preenchendo os orbitais 1s superpostos; esta ligação covalente é o resultado de serem ambos os elétrons capazes de reduzir suas energias, permanecendo nos orbitais 1s de dois átomos ao mesmo tempo (animação da Figura 1.e). Durante certa parte do tempo, entretanto, cada um dos elétrons estará na vizinhança de um único núcleo; a ligação é, então, primariamente eletrostática entre 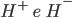 e é chamada iônica animação da Figura 1.e(b).
e é chamada iônica animação da Figura 1.e(b).
Uma situação como esta, onde a ligação é uma combinação de dois ou mais casos-limites de tipos de ligação, é a regra e não a exceção para a maioria dos materiais. Ainda assim é instrutivo distinguir os casos-limites de tipos de ligação e analisá-los individualmente, antes de considerar suas combinações em sólidos.
Ligações entre átomos maiores podem ser explicadas por considerações energéticas semelhantes às utilizadas para a molécula de 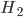 . Mas deve-se ter em conta que o tratamento é somente qualitativo e que apenas os elétrons mais externos, ou de valência, tomam parte na ligação.
. Mas deve-se ter em conta que o tratamento é somente qualitativo e que apenas os elétrons mais externos, ou de valência, tomam parte na ligação.
Figura 1.e – Representação esquemática das ligações covalente e iônica na molécula de  .
.