Ligações covalentes estáveis são formadas no estado sólido primariamente entre átomos não-metálicos, como hidrogênio (H), nitrogênio (N), oxigênio (O), carbono (C), flúor (F) e cloro (Cl). A animação da Figura 1.f mostra a distribuição de carga eletrônica entre dois átomos de hidrogênio isolados e após a formação da molécula de 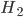 . Outros elementos, como silício (Si), germânio (Ge), arsênico (As) e selênio (Se), formam ligações que são parcialmente covalentes, parcialmente metálicas; os metais de transição (colunas IIIB—VIIB na Tabela Periódica, Apêndice IA), supõe-se, têm também certa quantidade de caráter covalente nas suas ligações.
. Outros elementos, como silício (Si), germânio (Ge), arsênico (As) e selênio (Se), formam ligações que são parcialmente covalentes, parcialmente metálicas; os metais de transição (colunas IIIB—VIIB na Tabela Periódica, Apêndice IA), supõe-se, têm também certa quantidade de caráter covalente nas suas ligações.
Compartilhamento de elétrons é a característica de ligações homopolares, como  . Neste caso, elétrons da subcamada p são compartilhados. A molécula de
. Neste caso, elétrons da subcamada p são compartilhados. A molécula de  tem uma ligação simples, pois o flúor tem um elétron a menos do que a configuração do gás nobre neônio, (Ne)
tem uma ligação simples, pois o flúor tem um elétron a menos do que a configuração do gás nobre neônio, (Ne)  . Similarmente,
. Similarmente, 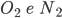 têm ligações duplas e triplas, respectivamente, devido à estrutura eletrônica do oxigênio
têm ligações duplas e triplas, respectivamente, devido à estrutura eletrônica do oxigênio 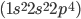 e a do átomo de nitrogênio
e a do átomo de nitrogênio 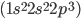 . Ligações múltiplas se refletem no valor da energia de ligação: 154 kJ/mol para o
. Ligações múltiplas se refletem no valor da energia de ligação: 154 kJ/mol para o 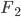 , 494 kJ/mol para o
, 494 kJ/mol para o 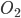 e 942 kJ/mol para o
e 942 kJ/mol para o  .
.
Um pré-requisito para uma ligação covalente forte é que cada átomo tenha, ao menos, um orbital semipreenchido. Somente assim pode a energia ser substancialmente reduzida quando um elétron da ligação for compartilhado nos orbitais de dois átomos, simultaneamente. Quanto maior a superposição dos orbitais de ligação, maior é a redução na energia do sistema, e mais forte a ligação. A quantidade de superposição é limitada, seja pela repulsão eletrostática, seja pela repulsão devida ao princípio de exclusão (orbitais completamente preenchidos não podem se superpor). A ligação covalente formada por orbitais superpostos tende também a situar-se na direção na qual o orbital está concentrado, obtendo-se deste modo a máxima superposição.
Átomos diferentes também produzem moléculas covalentes como  . Em cada caso, um átomo contribui com um elétron para par de elétrons de ligação. Outro tipo de ligação covalente, chamada de ligação covalente coordenada ou dativa, ocorre quando apenas um dos átomos fornece os dois elétrons, como na molécula de
. Em cada caso, um átomo contribui com um elétron para par de elétrons de ligação. Outro tipo de ligação covalente, chamada de ligação covalente coordenada ou dativa, ocorre quando apenas um dos átomos fornece os dois elétrons, como na molécula de 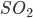 ou no íon amônio
ou no íon amônio  , resultado da reação
, resultado da reação
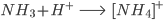
Outro exemplo de ligação covalente coordenada é a molécula de 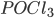 , onde os elétrons da ligação P-O são doados pelo átomo de fósforo, enquanto que na ligação P-Cl existe compartilhamento de elétrons.
, onde os elétrons da ligação P-O são doados pelo átomo de fósforo, enquanto que na ligação P-Cl existe compartilhamento de elétrons.
Valores de energias de ligação e uma lista de comprimentos de ligações covalentes são apresentados na Tabela 1.3.
Tabela 1.3. Comprimentos de ligações covalentes e valores de suas energias de ligação.

Observe que os valores de ligações múltiplas carbono-carbono possuem distâncias menores e maiores energias. Também não existe uma relação linear entre ligação simples, dupla ou tripla e valores de energia da ligação (uma ligação dupla não tem o dobro do valor de uma ligação simples). Uma das explicações seria a de que surgem novas formas para os orbitais quando eles se superpõem.
Figura 1.f – A distribuição de carga eletrônica entre dois átomos de hidrogênio isolados e após a formação da molécula de 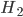 .
.