Os níveis de energia associados com os orbitais atômicos são mostrados na Figura 1.c. Estes níveis e sua ocupação pelos elétrons estão intimamente relacionados com os números quânticos. Quanto menor é o número quântico principal n, menor é o nível energético. Similarmente, quanto menor é o valor do número quântico do momento angular (l) do orbital (subcamada), menor é o nível de energia. O nível de energia de um átomo livre que não esteja submetido a campos elétricos e magnéticos depende apenas de n e l. No caso do átomo de hidrogênio (H), a energia depende só de n porque o hidrogênio conta com um único elétron.
O número máximo de elétrons em uma camada do nível energético é ditado pelo Príncípio de Exclusão de Pauli, visto que cada orbital comporta no máximo dois elétrons de spins contrários. Conseqüentemente, as subcamadas, caracterizadas pelos diferentes valores de l, podem acomodar diferentes números de elétrons, como mostrado na Tabela 1.2.
O número máximo de elétrons possíveis numa dada subcamada é fornecido pela fórmula de progressão ->número=2(2l+1). O número de estados numa subcamada é dado por (2l+1).
Tabela 1.2. População de elétrons

O número máximo de elétrons para um dado valor de n (quântico principal), isto é, o número máximo de elétrons numa dada camada, é a soma do número máximo de elétrons em cada subcamada ou
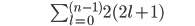 [1.1]
[1.1]
Assim, a ocupação máxima de uma camada com n=1 é idêntica ao número máximo de elétrons na subcamada 1s (2 elétrons); a ocupação máxima de uma camada com n=2 é a soma do número máximo de elétrons nas subcamadas 2s (2 elétrons) e 2p (6 elétrons), num total de 8 elétrons; a ocupação máxima de uma camada com n=3 é 18 elétrons. Cálculos desse tipo podem ser feitos para se obterem os valores para números quânticos principais maiores.
Figura 1.c – Os níveis de energia e os orbitais atômicos (densidade de probabilidade de se encontrar o elétron).