Para representar a localização espacial e a energia de um elétron num átomo, são necessários 4 números quânticos. Eles são usualmente representados pelas letras 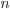 ,
,  ,
, 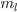 e
e 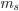 (1). Cada um deles só pode ter certos valores (Tab. 1.1).
(1). Cada um deles só pode ter certos valores (Tab. 1.1).
Tabela 1.1- Valores permitidos para os quatro números quânticos:

O número quântico principal n pode ser entendido como uma medida da energia total quantizada e pode assumir os valores 1, 2, 3,…, 7. Para n = 1 o elétron está no menor estado de energia ou, em outras palavras, orbita o mais próximo possível do núcleo atômico.
O segundo número quântico, l, chamado também de número quântico do momento angular, descreve o modo como o momento angular do elétron é quantizado e tem pequeno efeito sobre a energia; l pode ter somente os valores 0, 1,…, (n — 1). Os estados l são usualmente indicados por letras, para se evitar confusão com os valores de n: s é usado para l = 0; p para l = 1; d para l = 2; e f para l = 3. Quando n = 1, somente l = 0 é possível. Quando n = 2, tanto l = 0 como l = 1 são possíveis.
A teoria da Mecânica Quântica postula que o elétron não pode ser considerado como uma partícula que possui uma órbita com um raio definido. Existe a probabilidade de que o elétron seja encontrado em algumas posições. A localização do elétron é, então, melhor descrita como uma distribuição de densidade de probabilidade, que é também chamada de nuvem eletrônica. A simetria espacial da distribuição de probabilidade depende do valor de l. A nuvem eletrônica é esférica para elétrons s, mas possui geometrias complexas para outros níveis.
O terceiro número quântico 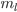 , chamado de número quântico magnético, governa a orientação espacial da distribuição de densidade de probabilidade eletrônica e é uma medida do ângulo entre o vetor momento angular do elétron e um campo magnético aplicado;
, chamado de número quântico magnético, governa a orientação espacial da distribuição de densidade de probabilidade eletrônica e é uma medida do ângulo entre o vetor momento angular do elétron e um campo magnético aplicado; 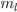 pode ter somente valores inteiros entre – l e +l, inclusive zero. Existem (2l+1) valores para
pode ter somente valores inteiros entre – l e +l, inclusive zero. Existem (2l+1) valores para  . Por exemplo, as três possibilidades da distribuição de densidade de probabilidade para o caso de l =1 (portanto, m = 2×1+1 = 3) são mostradas na Figura 1.b.
. Por exemplo, as três possibilidades da distribuição de densidade de probabilidade para o caso de l =1 (portanto, m = 2×1+1 = 3) são mostradas na Figura 1.b.
Cada combinação diferente de n, l e m corresponde a um estado quântico único chamado orbital. Os valores destes números quânticos especificam o tamanho, forma e orientação espacial do orbital eletrônico.
O quarto número quântico,  , é chamado número quântico do spin do elétron. De acordo com o princípio de exclusão de Pauli (Tópico 1.1), cada orbital não pode ter mais que dois elétrons, e estes dois devem ter spins opostos (
, é chamado número quântico do spin do elétron. De acordo com o princípio de exclusão de Pauli (Tópico 1.1), cada orbital não pode ter mais que dois elétrons, e estes dois devem ter spins opostos (  e
e  ). Usualmente utiliza-se uma seta para cima (
). Usualmente utiliza-se uma seta para cima ( ) para indicar
) para indicar 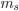 positivo (ou spin positivo) e seta para baixo (
positivo (ou spin positivo) e seta para baixo ( ) para indicar
) para indicar 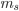 negativo. Para catalogar os elementos é suficiente designar apenas os valores de n e l e o número de elétrons em cada estado l. Por exemplo,
negativo. Para catalogar os elementos é suficiente designar apenas os valores de n e l e o número de elétrons em cada estado l. Por exemplo, 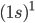 representa o hidrogênio (H),
representa o hidrogênio (H), 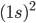 representa hélio (He),
representa hélio (He), 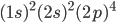 representa o oxigênio (O),
representa o oxigênio (O), 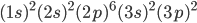 representa o silício (Si) etc. Note que os valores permitidos de
representa o silício (Si) etc. Note que os valores permitidos de  (Tab. 1.1) e
(Tab. 1.1) e  determinam quantos elétrons são necessários para preencher cada estado l.
determinam quantos elétrons são necessários para preencher cada estado l.
Figura 1.b – Arranjo espacial dos três orbitais 2p possíveis ( ). O número de orientações possíveis é (2l+1) ou 3 para l = 1. Se cada um dos orbitais é preenchido com elétrons, a nuvem eletrônica é simétrica em torno do núcleo. Assimetria e direcionalidade surgem quando os orbitais estão apenas parcialmente preenchidos.
). O número de orientações possíveis é (2l+1) ou 3 para l = 1. Se cada um dos orbitais é preenchido com elétrons, a nuvem eletrônica é simétrica em torno do núcleo. Assimetria e direcionalidade surgem quando os orbitais estão apenas parcialmente preenchidos.