Além das três ligações primárias (covalente, metálica, iônica) mencionadas, podem existir nos sólidos ligações algumas vezes chamadas de secundárias. São secundárias porque os valores das energias de ligação são muito menores que aqueles valores encontrados nas ligações covalente, metálica e iônica. Essas ligações secundárias são resultantes de atrações eletrostáticas de dipolos.
O termo secundário não significa que esse tipo de ligação tem uma importância secundária na natureza. Pelo contrário, as teorias sobre ligações de hidrogênio (algumas vezes chamadas de pontes de hidrogênio) e as forças de van de Waals-London (Veja Tópico 15) auxiliam na descrição de fenômenos vitais em Bioquímica (1) e em Biologia Molecular (2).
As ligações de hidrogênio são particularmente importantes para se entender o comportamento da água, de proteínas e de muitos polímeros.
Átomos ligados de modo covalente produzem, muitas vezes, moléculas que se comportam como dipolos permanentes, em especial quando o hidrogênio se liga a átomos muito eletronegativos, como nitrogênio (N), flúor (F) ou oxigênio (O). Ligações de hidrogênio formam-se apenas com os átomos mais eletronegativos (Veja Tabela Periódica no final da lista de Capítulos) porque são estes átomos que produzem os mais fortes dipolos.
Por exemplo, na molécula da água  , o oxigênio (O) compartilha dois orbitais p semipreenchidos com elétrons dos dois átomos de hidrogênio, como mostrado abaixo:
, o oxigênio (O) compartilha dois orbitais p semipreenchidos com elétrons dos dois átomos de hidrogênio, como mostrado abaixo:
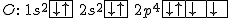

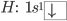
Devido ao fato de os elétrons compartilhados pelos átomos de oxigênio e hidrogênio tenderem a passar a maior parte do tempo na nuvem eletrônica do oxigênio (mais eletronegativo), o centro de cargas negativas fica neste átomo, que atua como o pólo negativo de um dipolo elétrico, e os átomos de hidrogênio tendem a atuar como pólos positivos. Cada um dos pólos positivos associa-se ao pólo negativo de outra molécula e, assim, as moléculas se ligam, como se mostra na animação da Figura 1.n.
As ligações de hidrogênio são direcionais. Assim, no gelo, as moléculas de água agregam-se em estruturas cristalinas, devido à direcionalidade das ligações H-O. Em função da direcionalidade, a agregação das moléculas de água no gelo produzem estruturas hexagonais com muito espaço interno e isto forneceria uma explicação para o fato de o gelo ser menos denso do que a água (3). A força das ligações de hidrogênio entre as moléculas de água decresce com o aumento de temperatura. À temperatura ambiente, a água líquida é composta de pequenos grupos de moléculas de 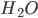 , associadas por ligações de hidrogênio.
, associadas por ligações de hidrogênio.
Outro exemplo dessa polarização molecular é ilustrado na animação das ligações na molécula de HF. Aqui, a ligação covalente entre hidrogênio e flúor resulta na formação de um dipolo e os dipolos atraem-se mutuamente.
Ligações de hidrogênio predominam nas moléculas de  , substâncias que possuem temperaturas de fusão muito maiores que as do
, substâncias que possuem temperaturas de fusão muito maiores que as do 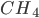 (Veja Tabela 1.4, Tópico 1.7, ligação covalente polar), em que predomina a ligação de tipo van der Waals entre as moléculas.
(Veja Tabela 1.4, Tópico 1.7, ligação covalente polar), em que predomina a ligação de tipo van der Waals entre as moléculas.
Figura 1.n. Ligações de hidrogênio originam-se nos dipolos produzidos pela assimetria das moléculas. A molécula de água 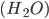 , mostrando-se o dipolo e a direção da atração entre as moléculas.
, mostrando-se o dipolo e a direção da atração entre as moléculas.