O valor da energia necessária para formar os íons deve ser compensada pela energia de ligação dos dois íons para que uma ligação estável se forme. Pode-se ver na Figura 1.l. que, se a energia de ligação for suficientemente grande, existe um mínimo na curva de energia potencial total versus distância. O mínimo ocorre à distância 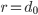 , onde as forças de atração e repulsão se equilibram. O afastamento desse espaçamento de equilíbrio
, onde as forças de atração e repulsão se equilibram. O afastamento desse espaçamento de equilíbrio 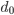 aumenta a energia potencial e produz então uma força de restituição.
aumenta a energia potencial e produz então uma força de restituição.
Ao contrário da ligação covalente, a ligação iônica é não-direcional. Cada íon positivo atrai todos os íons negativos vizinhos e vice-versa, de modo que, num grande agregado de íons, cada íon tende a ser rodeado por tantos íons de sinal oposto quantos podem tocá-lo simultaneamente.
Por exemplo, um íon sódio (Na) atrai um íon cloro (Cl), de modo a se ajustarem no NaCl. O lítio comporta-se de modo semelhante no LiF. O número real de íons que pode ser acomodado é ditado primeiro por fatores geométricos e segundo pela necessidade de preservação da neutralidade elétrica no sólido. As restrições geométricas aparecem porque os íons se comportam aproximadamente como esferas e, enquanto muitas esferas pequenas podem tocar simultaneamente uma esfera grande, poucas esferas grandes podem tocar simultaneamente uma esfera pequena. Esse aspecto da agregação iônica e atômica será discutido no Capítulo 2.
Se um composto químico irá formar-se por ligação iônica ou covalente, isso dependerá de qual mecanismo reduzirá mais a energia total. Em geral, quanto mais eletropositivo for o metal e mais eletronegativo for o não-metal, maior será a contribuição iônica para a ligação: LiF é quase completamente iônico; MgO tem pequeno caráter covalente nas suas ligações, e 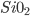 é aproximadamente metade iônico e metade covalente.
é aproximadamente metade iônico e metade covalente.
Figura 1.l – Energia potencial total de um par de íons em função da distância radial entre os íons