A ligação iônica resulta da atração eletrostática entre íons positivos e negativos, os quais se originaram de átomos livres pela perda ou ganho de elétrons. Átomos eletronegativos (átomos não-metálicos que tendem a adquirir elétrons e se tornam íons negativos) são aqueles que têm somente alguns poucos orbitais p semivazios; eles podem atrair um elétron externo para um dos orbitais semivazios, possibilitando ao elétron reduzir sua energia com relação àquele núcleo. Átomos eletropositivos (átomos metálicos que tendem a perder elétrons e tornar-se íons positivos) são aqueles que têm um ou mais elétrons fracamente ligados num nível de energia acima de uma camada eletrônica cheia.
Se um átomo livre eletropositivo e um eletronegativo forem aproximados suficientemente, de modo a se tornarem dois íons de cargas opostas, a energia potencial V do par de íons tornar-se-á mais negativa à medida que a distância radial de separação r decrescer:
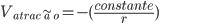 [1.5]
[1.5]
Porém, à medida que a distância de separação decresce, as nuvens eletrônicas dos dois íons começam a se superpor. Nesse instante, o princípio de exclusão de Pauli requer que alguns elétrons sejam promovidos para níveis de energia mais elevados. Um trabalho deve ser executado sobre os íons, a fim de forçá-los a se aproximarem, e a quantidade de trabalho necessário é inversamente proporcional a certa potência, m, da distância entre os centros dos íons. A energia potencial total dos dois íons será da forma
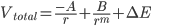 [1.6]
[1.6]
em que 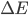 é a energia requerida para formar os dois íons a partir de átomos neutros. Na Figura 1.j,2. se
é a energia requerida para formar os dois íons a partir de átomos neutros. Na Figura 1.j,2. se 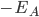 é a energia de um elétron s mais externo do átomo eletropositivo A, uma quantidade de trabalho igual a
é a energia de um elétron s mais externo do átomo eletropositivo A, uma quantidade de trabalho igual a 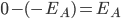 deve ser fornecida, a fim de removê-lo completamente do seu núcleo;
deve ser fornecida, a fim de removê-lo completamente do seu núcleo; 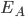 é chamado potencial de ionização. Se o elétron for agora colocado num orbital p semipreenchido do átomo eletronegativo B, ele poderá reduzir sua energia de zero a
é chamado potencial de ionização. Se o elétron for agora colocado num orbital p semipreenchido do átomo eletronegativo B, ele poderá reduzir sua energia de zero a  , em que
, em que 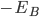 é a afinidade eletrônica. A variação líquida na energia deste elétron é então
é a afinidade eletrônica. A variação líquida na energia deste elétron é então 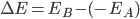 e é positiva, pois o potencial de ionização de A é maior que a afinidade eletrônica de B.
e é positiva, pois o potencial de ionização de A é maior que a afinidade eletrônica de B.
Figura 1.j.2. – Variações dos níveis de energia na formação de um par de íons, a partir de átomos livres.