Nem sempre podemos supor que a organização dos elétrons num orbital de um átomo livre é a mesma de um átomo ligado. Por exemplo, o carbono (C) 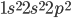 forma, algumas vezes, quatro ligações covalentes de igual valor (tanto na metana,
forma, algumas vezes, quatro ligações covalentes de igual valor (tanto na metana,  , como no diamante); com esta configuração não seria possível obter-se a metana, pois existem apenas dois orbitais p parcialmente preenchidos e capazes de realizar ligações.
, como no diamante); com esta configuração não seria possível obter-se a metana, pois existem apenas dois orbitais p parcialmente preenchidos e capazes de realizar ligações.
A explicação para as quatro ligações do carbono é que um dos elétrons 2s pode ser promovido ao orbital 2p. Essa promoção do elétron resulta em um orbital s semipreenchido e três orbitais p semipreenchidos, necessários para quatro ligações, todas têm o mesmo valor de energia de ligação. Tal rearranjo de orbitais é chamado hibridização e, neste caso, os quatro orbitais resultantes são chamados híbridos 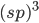 .
.
A Figura 1.h mostra a estrutura da metana (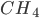 ).
).
Embora a seqüência de promoção energética do elétron e a hibridização
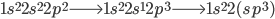
requeiram um aumento de energia do sistema, a formação de quatro ligações covalentes e a geometria da molécula resultam numa estrutura mais estável (com menor energia) do que se apenas duas ligações fossem formadas ( ).
).
O fato de que gases nobres (Xe, Kr) (1) formam ligações estáveis com flúor parece ter explicação semelhante à do carbono, exceto que, nestes casos, os elétrons são promovidos dos níveis p para d, em vez de s, para p.
No processo de hibridização, a direcionalidade nos orbitais híbridos é acompanhada de uma extensão espacial destes orbitais, o que facilita a superposição das nuvens eletrônicas durante a ligação.
Os orbitais das moléculas da água ( ) e da amônia (
) e da amônia (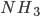 ) também podem ser analisados como híbridos
) também podem ser analisados como híbridos  , embora nestes casos cada um dos quatro orbitais não sejam equivalentes, visto que alguns são ocupados por pares de elétrons de valência que não participam da ligação.
, embora nestes casos cada um dos quatro orbitais não sejam equivalentes, visto que alguns são ocupados por pares de elétrons de valência que não participam da ligação.
Hibridização é um fenômeno comum, que explica a direcionalidade encontrada em vários tipos de ligações covalentes. Por exemplo, os orbitais híbridos 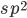 que formam ângulo de
que formam ângulo de  com um plano que passa pela ligação C=C, são parcialmente responsáveis pela ligação do carbono com três vizinhos na molécula do etileno (
com um plano que passa pela ligação C=C, são parcialmente responsáveis pela ligação do carbono com três vizinhos na molécula do etileno ( ). Orbitais híbridos sp, que formam
). Orbitais híbridos sp, que formam  entre si são importantes para a estrutura do acetileno
entre si são importantes para a estrutura do acetileno 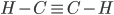 .
.
A hibridização envolve orbitais s, p e d, os quais são esquemas que podem ser utilizados para se deduzir a estrutura de muitos compostos de estrutura complexa.
Figura 1.h – Hibridização 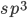 dos orbitais na molécula da metana (
dos orbitais na molécula da metana ( ).
).