Nas últimas décadas, foram descobertos novos vidros feitos de elementos ou compostos totalmente distintos daqueles com que são produzidos os vidros de janela. Nos anos 90 do século XX, surgiram, por exemplo, novas ligas metálicas amorfas feitas com zircônio (Zr), alumínio (Al), cobre (Cu) e níquel (Ni). Os metais eram, até bem pouco tempo, o exemplo típico de materiais cristalinos. Assim, ligas metálicas especiais podem se transformar em sólidos não-cristalinos se a taxa de resfriamento (graus centígrados/segundo) for elevada o suficiente para não ocorrer surgimento de partículas de fases cristalinas dentro do líquido (veja Capítulo 14, Mudanças de Fase) que se solidifica.
Mas pode-se considerar que vários materiais não-cristalinos têm uma característica em comum: suas estruturas são tais que os arranjos das sub-unidades (1) se emaranham completamente no estado líquido, que é quase impossível se desemaranharem depois quando o material estiver se solidificando. Os modos, segundo os quais os arranjos das subunidades se emaranham, são vários, mas podem ser agrupados em dois casos-limites: redes tridimensionais e moléculas de cadeias longas.
As redes tridimensionais (Figura 6.c) ocorrem quando as subunidades são poliedros de coordenação (2) (veja Tópico 3 “agregação iônica”, Capítulo 2) que compartilham somente os vértices, por meio de ligações covalentes ou iônicas. Este tipo de ligação permite muitos arranjos espaciais diferentes, bastando que o ângulo de ligação entre os dois poliedros varie aleatoriamente. Estes arranjos espaciais são equivalentes, em termos de energia, porque a proporção de orbitais atômicos (Veja Capítulo 1) superpostos difere muito pouco de um arranjo para outro. Como somente pouquíssimos desses arranjos podem ter ordem de longa distância, a maioria deles representará estruturas não-cristalinas.
O outro caso-limite de sólido não-cristalino ocorre quando as subunidades são cadeias moleculares muito longas e flexíveis (Figura 6.d), que se emaranham de modo muito semelhante ao espaguete cozido. Nesta analogia, uma estrutura cristalina corresponderia ao arranjo regular dos espaguetes retos e alinhados, formando um conjunto com ordem tridimensional a longa distância. Esta estrutura, provavelmente, não se formará espontaneamente. As subunidades têm muito pouca mobilidade no líquido e esta pequena mobilidade molecular ou atômica diminui com a temperatura. Quando este líquido resfria e se solidifica, a estrutura permanece não-cristalina indefinidamente, pois para cristalizá-la seria necessário muito mais movimento atômico do que é realmente possível num sólido.
Materiais não-cristalinos não têm temperatura de solidificação definida, como os materiais cristalinos, e eles se tornam gradualmente mais viscosos à medida que cai a temperatura. Como as subunidades não têm, todas, arredores idênticos, não terão energias de ligação iguais, ainda que as diferenças possam ser pequenas. À medida que um material com esse tipo de estrutura se resfria, os movimentos de translação e rotação das sub-unidades é cada vez mais difícil. As vibrações atômicas também vão diminuindo de amplitude. Assim, ligações de energia mais baixa (mais negativas) começam-se a formar entre subunidades e começam a travar localmente, entre si, conjuntos de subunidades. À medida que a temperatura abaixa mais, este processo se intensifica com as ligações mais fracas se formando gradualmente até que o material fique completamente rígido.
A faixa de temperatura na qual o líquido está se solidificando é a faixa da temperatura de transição vítrea (veja Tópico 1 deste capítulo), Tg, porque, em temperaturas mais baixas do que esta faixa, o material será um sólido vítreo, um vidro, e em temperaturas mais altas ele fluirá como um líquido muito viscoso.
Fig. 6.c – (1) Estrutura do quartzo (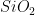 , Cristalino) e (2) estrutura do vidro de quartzo. Os átomos de oxigênio são representados por esferas grandes, e átomos de silício por pequenas esferas escuras ou tetraedros de Si—O. Os vértices dos tetraedros correspondem aos centros dos átomos de oxigênio.
, Cristalino) e (2) estrutura do vidro de quartzo. Os átomos de oxigênio são representados por esferas grandes, e átomos de silício por pequenas esferas escuras ou tetraedros de Si—O. Os vértices dos tetraedros correspondem aos centros dos átomos de oxigênio.
Fig. 6.d – Estrutura de um polímero (poli=muitos, meros=sub-unidades, monômeros)