De importância básica é o Enunciado de Rudolf Clausius (1):
O calor flui espontaneamente de um corpo que está em alta temperatura para um corpo que está em temperatura mais baixa. Matematicamente, isto pode ser expresso pela seguinte equação
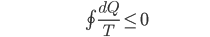 (10.8)
(10.8)
Onde a integral é tomada ao longo de um ciclo completo. A desigualdade se aplica a ciclos irreversíveis, e a igualdade a ciclos reversíveis, T é a temperatura absoluta (escala Kelvin) (2). De acordo com o Teorema de Clausius, nós não poderíamos simplesmente extrair calor e convertê-lo em trabalho. Durante o ciclo seria necessário também rejeitar calor a fim de satisfazer a Eq. (10.8).
O calor rejeitado, naturalmente, representa aquela parte do calor absorvido que não pode ser convertida em trabalho. Além disso, a rejeição do calor (Q) deve ocorrer em temperaturas mais baixas que a absorção de calor, se desejamos realizar trabalho (W).
Isto é fácil de ser verificado: a Primeira Lei da Termodinâmica (Eq. (10.1), veja Tópico 10.1) diz que a diferença entre o calor absorvido e o calor cedido deve ser igual ao trabalho realizado. Se o trabalho (W) é positivo, a quantidade de calor cedido será sempre inferior à quantidade de calor absorvido.
Em conseqüência, a faixa de temperaturas na qual ocorre rejeição de calor é, em geral, inferior à faixa de temperaturas na qual o calor é absorvido, para que seja satisfeito o Teorema de Clausius (Equação 10.8). Se o calor é absorvido numa temperatura fixa, a Eq. (10.8) exige que o mesmo calor seja rejeitado àquela temperatura, e nenhum trabalho será realizado. A desigualdade no exemplo acima corresponde ao rendimento inferior dos processos irreversíveis; a maior parte do calor absorvido deve ser rejeitada e, apenas uma menor parte será convertida em trabalho (W).
Figura 10.g- Calor produzindo trabalho.