O teorema de Clausius (Equação (10.8), Tópico anterior) se propõe a descrever os fenômenos naturais. O alvo desta descrição poderá agora ser ampliado pela introdução de uma nova variável termodinâmica também proposta por Clausius, a entropia, cujo símbolo é S. A entropia tem dimensão de energia, de calor (caloria (cal), Joule (J)) por unidade de temperatura absoluta em kelvin (K). Até aqui, os exemplos de conversão de calor em trabalho foram através de vários dispositivos cíclicos; agora, a Segunda Lei será estendida aos eventos naturais “espontâneos”.
Inicialmente, Clausius chamou esta quantidade de energia que é gasta para levar um sistema de um estado para outro de conteúdo de transformação. Esta energia, o sistema gasta na colisão entre moléculas, no movimento aleatório de átomos e moléculas que não resulta em trabalho. Esta energia é gasta na desordem do sistema. Mais tarde, Clausius cunhou o termo entropia (S) (1) para este conteúdo de energia gasto na mudança do sistema de um estado para outro.
A maneira mais simples de isto ser conseguido é usando o Teorema de Clausius para que seja definida uma nova função de estado. Para um ciclo reversível, a integral da Equação 10.8 (Veja Tópico anterior) é igual a zero. Dois estados termodinâmicos ligados por quaisquer dois caminhos reversíveis constituem um tal ciclo, independentemente do caminho. Portanto, a integral
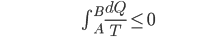 (10.9)
(10.9)
que liga os estados B e A é uma função unicamente dos estados inicial (A) e final (B), e não dos caminhos que os ligam. Em conseqüência, a diferencial da entropia
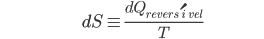 (10.10)
(10.10)
Está sendo integrada acima. Verificamos, também, a partir da Eq. (10.8), que a relação
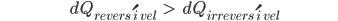 (10.11)
(10.11)
Deve aplicar-se a métodos reversíveis e irreversíveis para a mesma mudança de estado. Consideremos uma mudança de estado, arbitrariamente pequena, na qual transfere-se o calor dQ. Pela Eq. (10.11)
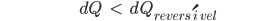 (10.12)
(10.12)
A variação da entropia do sistema, independentemente da reversibilidade, é
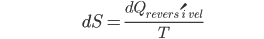 (10.13)
(10.13)
pois a entropia é determinada unicamente pelos estados inicial e final. Como dQ é muito pequeno, a vizinhança do sistema pode retornar ao seu estado inicial pela reposição de dQ; supomos que todas as outras variações sejam de segunda ordem. A variação de entropia da vizinhança do sistema pode ser obtida pela reposição de dQ de maneira reversível:
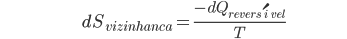 (10.14)
(10.14)
A variação líquida de entropia durante qualquer mudança diferencial de estado desse tipo será
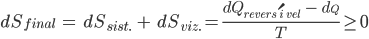 (10.15)
(10.15)
A igualdade da equação acima se refere à reversibilidade. Um processo que ocorre espontaneamente é irreversível por natureza, do contrário não ocorreria. A reversibilidade pode ser atingida somente quando o equilíbrio está tão próximo que nenhuma mudança observável possa ocorrer. De acordo com a Eq. (10.15), qualquer evento espontâneo (natural) implica em um aumento da entropia total. A igualdade na Eq. (10.15) significa que a entropia se torna máxima no equilíbrio.
Estas afirmações e a equação (10.15) constituem a forma mais geral da Segunda Lei.
Figura 10.h- Entropia