Quando metais dessemelhantes em contato elétrico são imersos em um eletrólito, ocorre corrosão aquosa. Um dos metais, chamado ânodo, dissolve-se como íons positivos. Os elétrons gerados deste modo fluem através do contato elétrico com o outro metal (chama-se cátodo), onde, usualmente, os íons de hidrogênio (1) são reduzidos quimicamente (ganham elétrons) a átomos e moléculas de 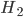 , criam íons de hidroxila (
, criam íons de hidroxila (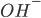 ), ou os íons de (
), ou os íons de (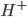 ) participam de uma reação semelhante de redução. Conseqüentemente, a velocidade de corrosão é proporcional à corrente elétrica e está associada a ela. O fato de um metal ser anódico ou catódico dependerá da sua propensão para ionizar-se. É comum expressar a propensão para ionizar em termos de voltagem, em vez de energia livre. Uma tabulação de tais voltagens é chamada uma série de força eletromotriz (FEM). A voltagem depende da concentração de íons na solução e da blindagem do cátodo pelos produtos da reação (polarizacão). Para um dado ambiente, pode-se construir uma tabela onde se colocam os materiais na ordem de suas tendências anódicas. Tal tabela é chamada Série Galvânica. Diferenças de microestrutura, deformação plástica, acesso ao oxigênio, concentração de íons, ou qualquer outra coisa que afete a energia livre de ionização, levarão à corrosão. Certos materiais são passivos, isto é, possuem camadas de óxido extremamente estáveis nas suas superfícies, mas somente em certos meios ambientes. A corrosão pode ser controlada pela polarizaçao catódica, passivação, inibição, isolamento e proteção catódica.
) participam de uma reação semelhante de redução. Conseqüentemente, a velocidade de corrosão é proporcional à corrente elétrica e está associada a ela. O fato de um metal ser anódico ou catódico dependerá da sua propensão para ionizar-se. É comum expressar a propensão para ionizar em termos de voltagem, em vez de energia livre. Uma tabulação de tais voltagens é chamada uma série de força eletromotriz (FEM). A voltagem depende da concentração de íons na solução e da blindagem do cátodo pelos produtos da reação (polarizacão). Para um dado ambiente, pode-se construir uma tabela onde se colocam os materiais na ordem de suas tendências anódicas. Tal tabela é chamada Série Galvânica. Diferenças de microestrutura, deformação plástica, acesso ao oxigênio, concentração de íons, ou qualquer outra coisa que afete a energia livre de ionização, levarão à corrosão. Certos materiais são passivos, isto é, possuem camadas de óxido extremamente estáveis nas suas superfícies, mas somente em certos meios ambientes. A corrosão pode ser controlada pela polarizaçao catódica, passivação, inibição, isolamento e proteção catódica.
A corrosão aquosa de metais ocorre quando átomos metálicos dissolvem-se como íons em um meio aquoso. Como isto ocorre quando metais dessemelhantes são colocados em contato elétrico na presença de um eletrólito, diz-se que a corrosão é de natureza eletroquímica. O termo “dessemelhante” é usado para indicar que ocorrem diferentes variações de energia livre (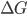 ) quando quantidades equivalentes de cada metal são ionizadas e dissolvidas no meio ambiente, começando nas respectivas superfícies metálicas. Como vemos, a dessemelhança pode decorrer da concentração de íons no meio ambiente, velocidade do eletrólito, da microestrutura dos metais, tensão mecânica, películas superficiais e muitas outras causas. Os prejuízos econômicos anuais decorrentes da corrosão são extremamente altos. A Figura 19.a apresenta exemplos de oxidação.
) quando quantidades equivalentes de cada metal são ionizadas e dissolvidas no meio ambiente, começando nas respectivas superfícies metálicas. Como vemos, a dessemelhança pode decorrer da concentração de íons no meio ambiente, velocidade do eletrólito, da microestrutura dos metais, tensão mecânica, películas superficiais e muitas outras causas. Os prejuízos econômicos anuais decorrentes da corrosão são extremamente altos. A Figura 19.a apresenta exemplos de oxidação.
Figura 19.a – Exemplos de corrosão de metais.