Quando a velocidade líquida da reação for zero, existirá equilíbrio termodinâmico e as velocidades nos dois sentidos serão iguais.
Igualando a zero a equação (13.10) do Tópico anterior, obteremos:
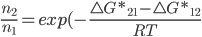
ou
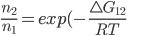 (13.11)
(13.11)
Esta é exatamente a equação termodinâmica para o equilíbrio do sistema descrito na Figura 13.f (veja tópico anterior). Nos sistemas químicos,  é chamada de constante de equilíbrio. A equação (13.11) é uma equação geral para o problema. Além do equilíbrio químico, ela pode ser utilizada para descrever propriedades eletrônicas de materiais (densidade eletrônica do átomo, distribuição do momento magnético em agregados atômicos e moleculares, etc.) e em qualquer outra situação em que a energia térmica é uma fonte de energia de ativação.
é chamada de constante de equilíbrio. A equação (13.11) é uma equação geral para o problema. Além do equilíbrio químico, ela pode ser utilizada para descrever propriedades eletrônicas de materiais (densidade eletrônica do átomo, distribuição do momento magnético em agregados atômicos e moleculares, etc.) e em qualquer outra situação em que a energia térmica é uma fonte de energia de ativação.
As conclusões dos tópicos 13.2 e 13.3 devem agora ser modificadas pelos conceitos termodinâmicos introduzidos pelas equações 13.8, 13.9 e 13.10. A Equação de Arrhenius descreve a reação apenas a uma certa distância do equilíbrio. Um exemplo disto é que 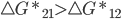 na Figura 13.f e na equação (13.10).
na Figura 13.f e na equação (13.10).
A energia de ativação Q da Equação de Arrhenius é, na realidade, a entalpia de ativação (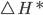 ), como mostrado na equação (13.9). A entalpia de ativação (
), como mostrado na equação (13.9). A entalpia de ativação ( ) descreve apenas a dependência da velocidade da reação com a temperatura, e não inclui variações de entropia (
) descreve apenas a dependência da velocidade da reação com a temperatura, e não inclui variações de entropia (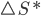 ). Quando se avaliam dados experimentais, estas variações devem ser encontradas na constante c que multiplica a exponencial da Equação de Arrhenius. É o efeito da entropia (S) que torna difícil o cálculo completo das velocidades a partir dos primeiros princípios.
). Quando se avaliam dados experimentais, estas variações devem ser encontradas na constante c que multiplica a exponencial da Equação de Arrhenius. É o efeito da entropia (S) que torna difícil o cálculo completo das velocidades a partir dos primeiros princípios.