Para descrever a velocidade de uma reação é necessário levar em conta, além da entalpia (H), as variações de entropia (S) que são significativas, particularmente quando um grande número de átomos deve reagir simultaneamente. A expressão da probabilidade [Equação (13.5)] pode ser escrita em função da energia livre de ativação por mol ou barreira de energia livre 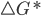 , isto é:
, isto é:
 (13.8)
(13.8)
Como  , teremos:
, teremos:
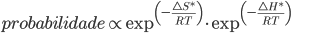 (13.9)
(13.9)
Na figura 13.f é mostrada esquematicamente a evolução de uma reação com a variação de energia livre sendo utilizada como parâmetro de estabilidade da reação. A reação de (1) para (2) é termodinamicamente favorável, pois ocorre um decréscimo da energia livre do sistema ( 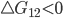 ), e a velocidade de (1) para (2) será governada pela barreira
), e a velocidade de (1) para (2) será governada pela barreira 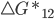 . Já a reação contrária, de (2) para (1), não é termodinamicamente favorecida (
. Já a reação contrária, de (2) para (1), não é termodinamicamente favorecida ( ); hipoteticamente, entretanto, poderia ocorrer ainda a uma velocidade controlada por
); hipoteticamente, entretanto, poderia ocorrer ainda a uma velocidade controlada por 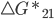 .
.
A velocidade líquida resultante da reação será obtida pela diferença entre as velocidades de (1) para (2) e de (2) para (1):
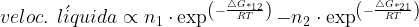 (13.10)
(13.10)
Os termos 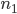 e
e  são os números de unidades (átomos, moléculas, núcleos, etc.) nos estados (1) e (2), respectivamente. Quando
são os números de unidades (átomos, moléculas, núcleos, etc.) nos estados (1) e (2), respectivamente. Quando 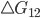 é negativo, a velocidade de reação de (1) para (2) supera a de (2) para (1). Quando
é negativo, a velocidade de reação de (1) para (2) supera a de (2) para (1). Quando 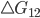 é positivo, a reação contrária de (2) para (1) ocorre mais rapidamente e o papel de reagentes e produtos da reação é invertido.
é positivo, a reação contrária de (2) para (1) ocorre mais rapidamente e o papel de reagentes e produtos da reação é invertido.
Figura 13.f – Variações da energia livre de Gibbs 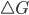 de uma reação.
de uma reação.