Considere agora uma interface líquido-sólido, por exemplo, a interação da água com as paredes de um tubo capilar de vidro. Os átomos da superfície hidrofílica (1) do vidro reagem com as moléculas da água. Devido ao movimento do nível dágua, camadas moleculares de 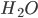 ficam presas às paredes de vidro, acima do nível inicial. Estas camadas sucessivas estão mais fortemente aderidas na parede, onde a interação é mais forte, e vão ficando progressivamente mais frágeis à medida que nos distanciamos da parede do capilar. As moléculas do vapor de água também auxiliam este processo, pois condensam-se na parede de vidro vizinha à superfície (Veja animação na Figura 12.c). O final (macroscópico) do processo é a formação de um anel acima do nível da água (um menisco).
ficam presas às paredes de vidro, acima do nível inicial. Estas camadas sucessivas estão mais fortemente aderidas na parede, onde a interação é mais forte, e vão ficando progressivamente mais frágeis à medida que nos distanciamos da parede do capilar. As moléculas do vapor de água também auxiliam este processo, pois condensam-se na parede de vidro vizinha à superfície (Veja animação na Figura 12.c). O final (macroscópico) do processo é a formação de um anel acima do nível da água (um menisco).
A temperatura desempenhará um papel central neste processo. Quanto maior a temperatura da água, menor será a altura do menisco. Quanto menor a temperatura, maior a altura do menisco.
Macroscopicamente isto ocorre porque, quanto maior é a temperatura, menor é a viscosidade 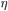 (2) da água. Quanto menor a viscosidade (que é a medida de atrito interno do líquido), maior a fluidez e menor a altura que o menisco consegue atingir.
(2) da água. Quanto menor a viscosidade (que é a medida de atrito interno do líquido), maior a fluidez e menor a altura que o menisco consegue atingir.
De um ponto de vista atômico e molecular, a tensão superficial  diminui com a temperatura porque o aumento da agitação térmica das moléculas de água aumenta a distância média entre elas e reduz a magnitude das forças atrativas intermoleculares (no caso da água, ligações de hidrogênio). A Tabela 12.1 apresenta os valores de tensão superficial (
diminui com a temperatura porque o aumento da agitação térmica das moléculas de água aumenta a distância média entre elas e reduz a magnitude das forças atrativas intermoleculares (no caso da água, ligações de hidrogênio). A Tabela 12.1 apresenta os valores de tensão superficial (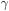 ) [unidade: mN (miliNewton)/m(metro)] (3) e da tensão interfacial (com a água) (
) [unidade: mN (miliNewton)/m(metro)] (3) e da tensão interfacial (com a água) ( ) de alguns líquidos à temperatura de 20 oC. Nesta temperatura,
) de alguns líquidos à temperatura de 20 oC. Nesta temperatura,  da água é ~ 72,8 mN/m. A 100
da água é ~ 72,8 mN/m. A 100 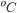 o valor de
o valor de 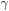 é de aproximadamente 59 mN/m.
é de aproximadamente 59 mN/m.
Tabela 12.1-Tensão superficial e interfacial (com a água) de alguns líquidos a 20 oC (Valores em mili Newtons (mN)/metro)

Repare que 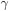 é muito maior para os metais (compare o valor de Hg com a água). A razão é que as forças que mantêm as moléculas de água unidas (ligações de hidrogênio) são muito mais fracas do que as ligações entre os átomos de um metal no estado líquido.
é muito maior para os metais (compare o valor de Hg com a água). A razão é que as forças que mantêm as moléculas de água unidas (ligações de hidrogênio) são muito mais fracas do que as ligações entre os átomos de um metal no estado líquido.
Figura 12.c – Animação mostrando o processo de formação de um menisco num capilar com água e o efeito da temperatura na altura do menisco de água