Podemos agora obter a energia livre de uma solução típica, subtraindo o valor da entalpia (H) do produto da entropia (S) total da mistura pela temperatura (T). São 3 os tipos de desvios: ideal, positivo e negativo. Para desvios negativos e para as soluções ideais, vemos que a energia livre da mistura ( ) é sempre menor do que G dos dois componentes isolados e concluímos que as soluções são estáveis.
) é sempre menor do que G dos dois componentes isolados e concluímos que as soluções são estáveis.
O desvio positivo é mais complexo. Em temperaturas altas o termo TS será predominante na variação de energia livre (G) com a mistura, e a solução será sempre estável. Em temperaturas baixas (este caso é mostrado na Figura 11.i), a contribuição positiva da entalpia se torna importante. A energia livre de mistura ( ), no caso de misturas próximas do centro da Figura 11.i, possuem:
), no caso de misturas próximas do centro da Figura 11.i, possuem:
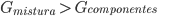 (11.4)
(11.4)
significando isto que tais soluções são instáveis, pois o sistema precisa de mais energia do que dispõe para que estas misturas existam.
Figura 11.i – O cálculo da energia livre de Gibbs (G) a partir dos termos H e TS mostrando as possibilidades de desvios negativo, ideal e positivo em baixas temperaturas.