A outra contribuicão para a energia livre, a entalpia (H), pode significar tanto uma tendência para ocorrer a mistura como uma tendência para a separação. Nos sólidos as variações de volume são relativamente pequenas e, portanto, podemos tomar a entalpia (H=E+PV) como igual à energia interna (E), pois 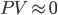 . Uma análise qualitativa da entalpia de mistura (
. Uma análise qualitativa da entalpia de mistura ( ) pode então ser deduzida a partir de considerações sobre a energia de ligação. Se os átomos A preferirem a vizinhança de átomos B e não de outros átomos A, e se os átomos B se comportarem também da mesma forma, a energia (ou entalpia) será reduzida ao ocorrer a mistura. Isto é verdade porque as energias de ligação são negativas no caso de ligações estáveis; e quanto mais fortes as ligações, mais fortemente negativas elas serão. Em conseqüência, na animação da Figura 11.h, em que as linhas tracejadas representam a entalpia total antes de ocorrer a mistura, a entalpia após a mistura fica abaixo da linha tracejada, para todas as composições. É de se esperar que o maior decréscimo de entalpia ocorra na composicão 50-50, pois um número máximo de “ligações A—B” ocorrerá neste valor, se a mistura for realmente homogênea. Esta situação está indicada na Figura 11. h, e é denominada desvio negativo da condição ideal. A situação ideal também é mostrada na Figura 11.h. Aqui a forca de ligação é a mesma para as combinações A—A, B—B e A—B, e nenhuma variação de entalpia ocorre com a mistura.
) pode então ser deduzida a partir de considerações sobre a energia de ligação. Se os átomos A preferirem a vizinhança de átomos B e não de outros átomos A, e se os átomos B se comportarem também da mesma forma, a energia (ou entalpia) será reduzida ao ocorrer a mistura. Isto é verdade porque as energias de ligação são negativas no caso de ligações estáveis; e quanto mais fortes as ligações, mais fortemente negativas elas serão. Em conseqüência, na animação da Figura 11.h, em que as linhas tracejadas representam a entalpia total antes de ocorrer a mistura, a entalpia após a mistura fica abaixo da linha tracejada, para todas as composições. É de se esperar que o maior decréscimo de entalpia ocorra na composicão 50-50, pois um número máximo de “ligações A—B” ocorrerá neste valor, se a mistura for realmente homogênea. Esta situação está indicada na Figura 11. h, e é denominada desvio negativo da condição ideal. A situação ideal também é mostrada na Figura 11.h. Aqui a forca de ligação é a mesma para as combinações A—A, B—B e A—B, e nenhuma variação de entalpia ocorre com a mistura.
O desvio positivo também é mostrado na animação da Figura 11.h. Esta situação ocorre quando os átomos A e B preferem a companhia dos seus iguais. A energia de ligacão média, após a mistura, é menos negativa e, portanto, a entalpia cresce com a mistura.
Naturalmente, estas considerações são uma simplificação das situações reais. Deformações da rede devidas às diferenças de tamanho atômico não foram consideradas. A energia de uma solução real, constituída de um número muito grande de átomos, é muito mais complicada que a ligação de um único átomo e muitas soluções sólidas não são completamente homogêneas no equilíbrio. Mesmo com estas limitações, as curvas da Figura 11.h são qualitativamente corretas para a maioria dos casos.
Figura 11.h – Diagramas composição-entalpia (H).