A partir dos vários diagramas composição-energia livre de Gibbs (G), é possível prever os diagramas de fase para sistemas binários típicos.
(Para a discussão que se segue, considere também as Figuras 11.i e 11.m, Tópico 11.9 e 11.11) .
Para um sistema binário que forma uma solução sólida ideal ou com desvio negativo de entalpia, existirá apenas uma única fase sólida. À medida que a temperatura sobe, a curva de energia livre do líquido fica abaixo da curva do sólido, e ocorrerá uma situação semelhante à de 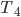 , da Figura 11.m (Veja Tópico anterior). O formato do diagrama binário será como o indicado na Figura 11.n.1.
, da Figura 11.m (Veja Tópico anterior). O formato do diagrama binário será como o indicado na Figura 11.n.1.
Se a solução sólida apresentar um desvio positivo de entalpia (Veja Figura 11.i), ela deverá possuir uma única fase em altas temperaturas, e a separação em duas fases estáveis, em temperaturas mais baixas. Esta situação, que ocorre, por exemplo, em misturas de dois silicatos, é denominada falha (ou hiato) de miscibilidade. A falha de imiscibilidade está representada na parte inferior da Figura 11.n.2. O ponto mínimo nas curvas de solidus e liquidus, na Figura 11.n.2, é também causado pelo desvio positivo na entalpia. A “corcova” que aparece na curva composição-energia livre de Gibbs (G) da solução sólida existe apenas em baixas temperaturas. À medida que a temperatura sobe a “corcova” vai desaparecendo. Uma série completa de soluções sólidas só se formará se a curva de energia livre do líquido não cortar a curva de energia livre do sólido antes que a “corcova” desapareça. Neste caso, a curva de energia livre da solução sólida tem geralmente uma curvatura menos pronunciada que a do líquido, e ocorrerá um ponto de fusão mínimo, como na Figura 11.n.2.
Por outro lado, se a curva de energia livre do líquido descer e cortar a da solução sólida antes que sua “corcova” desapareça, então ocorrerá uma reação eutética. O diagrama de fases resultante é semelhante à Figura 11.n.3, exceto que ambas as soluções sólidas finais terão a mesma estrutura cristalina.
Em geral, a reação eutética mostrada na Figura 11.n.3 resulta das interseções e tangentes às curvas de energia livre discutidas no caso da Figura 11.l.
O diagrama da Figura 11.n.4 ocorre em muitos casos em que um componente tem um ponto de fusão relativamente baixo. À medida que a temperatura sobe, a curva de energia livre do líquido desce primeiramente à direita da curva de 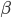 e não à esquerda, como na Figura 11.l .
e não à esquerda, como na Figura 11.l .
A transformação invariante
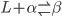
se chama reação peritética.
Figura 11.n. Diagramas de fase binários com (a) Completa solubilidade sólida; (b) Ponto mínimo de fusão. Solubilidade de um sólido no outro só não ocorre na falha de imiscibilidade: 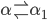 ;(c) Solubilidade sólida limitada, reação eutética em
;(c) Solubilidade sólida limitada, reação eutética em 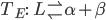 ; (d) Solubilidade sólida limitada, reação peritética em
; (d) Solubilidade sólida limitada, reação peritética em 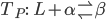 .
.