Em 1877, Ludwig Boltzmann (1) prôpos interpretar a entropia (S) como um fenômeno probabilístico: a entropia seria proporcional ao número de “microestados” existentes nos átomos que formam um gás ideal.
Em outras palavras, se considerarmos os fenômenos em escala atômica ou molecular (subnanométrica e nanométrica) (2) a entropia é a expressão macroscópica de um número muito grande de configurações subnanométricas e nanométricas possíveis que, conjuntamente, produzem uma determinada organização macroscópica de um sistema. A equação proposta por Boltzmann é
 (10.16)
(10.16)
Onde S é a entropia, W (3) é o número de configurações macroscópicas e 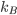 (4) é a constante de Boltzmann.
(4) é a constante de Boltzmann.
A Termodinâmica Estatística propõe uma explicação para os fenômenos termodinâmicos baseada em duas teorias fundamentais: o atomismo e a teoria das probabilidades, isto é, a desordem e a irreversibilidade. São expressões de desordem e irreversibildade que existem numa escala atômica.
Figura 10.i – Ludwig Boltzmann (1844-1906)