10.4.1-Entalpia(H)
A entalpia (1) é uma das mais importantes funções termodinâmicas de estado, é representada pela letra H e decorre da aplicação da primeira lei (Veja Tópico anterior) aos processos a pressão constante. Matematicamente, define-se entalpia pela equação
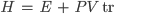 (10.2)
(10.2)
onde,
H é a entalpia, E é a energia interna, P é a pressão e V é o volume.
A entalpia, sendo a soma de uma energia com um produto (PV) que tem dimensões de energia, tem de ser expressa também em unidades de energia (Joule (J), caloria (cal), etc).
A entalpia H pode ser deduzida da aplicação da primeira lei, num processo a pressão constante. Para isto, considere a evolução de um sistema do estado de energia interna 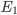 para um estado de energia interna
para um estado de energia interna 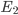 que recebe a quantidade de calor Q (animação da Figura 10.d)
que recebe a quantidade de calor Q (animação da Figura 10.d)
 (10.3)
(10.3)
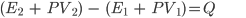
Sabemos que H = E + PV, então teremos:
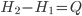 ou
ou
 (10.4)
(10.4)
Portanto, quando a transformação é à pressão constante, a variação de entalpia (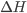 ) é igual ao calor absorvido ou liberado (Q) no processo.
) é igual ao calor absorvido ou liberado (Q) no processo.
Para a definição do estado termodinâmico de um sistema necessita-se dos valores de P, V; e sabemos também que E (energia interna) é uma função de estado. Assim H será também uma função de estado.
A variação de entalpia é muito importante no estudo de reações químicas e transformações de fase que ocorrem com absorção (reações endotérmicas) ou liberação de calor (reações exotérmicas).
A entalpia depende do estado de agregação (gás, líquido ou sólido), da temperatura e da estrutura cristalina do material.
Nas transformações com variação de pressão, a entalpia, evidentemente, não é igual ao calor liberado ou absorvido na transformação.
10.4.2- Calor Específico (c)
O calor específico (c) de uma substância é definido como a quantidade de calor necessária para aquecer de 1º C uma unidade de massa dessa substância, a uma dada temperatura. Podemos calcular o calor específico de uma substância, num intervalo de temperaturas (de 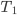 a
a 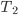 ), pela equação
), pela equação
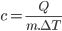 (10.5)
(10.5)
Onde Q é quantidade de calor absorvido ou liberado; 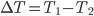 é o intervalo de temperatura estudado (2) e m é a massa da substância.
é o intervalo de temperatura estudado (2) e m é a massa da substância.
Se a pressão (P) e a volume (V) são mantidos constantes, pode-se demonstrar que o calor específico à pressão constante (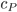 ) durante uma variação de temperatura muito pequena pode ser obtido pela equação
) durante uma variação de temperatura muito pequena pode ser obtido pela equação
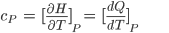 (10.6)
(10.6)
Onde 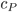 é calor específico à P=constante, H é a entalpia, Q é o calor absorvido ou liberado na transformação e T é a temperatura. À pressão constante
é calor específico à P=constante, H é a entalpia, Q é o calor absorvido ou liberado na transformação e T é a temperatura. À pressão constante  e, na forma de diferencial, dQ = dH.
e, na forma de diferencial, dQ = dH.
Figura 10.d- Sistema onde ocorre aumento de volume (de 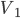 para
para 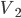 ), a pressão constante, devido à absorção de uma quantidade de calor Q.
), a pressão constante, devido à absorção de uma quantidade de calor Q.