A energia livre de Gibbs  é uma função de estado que diminui em todas as mudanças espontâneas e assume um valor mínimo no equilíbrio termodinâmico. Reações espontâneas são aquelas cuja variação em G, isto é,
é uma função de estado que diminui em todas as mudanças espontâneas e assume um valor mínimo no equilíbrio termodinâmico. Reações espontâneas são aquelas cuja variação em G, isto é,  são negativas. A variação em G (
são negativas. A variação em G ( ) informa sobre a direção das reações:
) informa sobre a direção das reações:
 ocorrência da reação é favorável
ocorrência da reação é favorável
 ocorrência da reação não é favorável nem desfavorável
ocorrência da reação não é favorável nem desfavorável
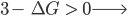 ocorrência da reação é desfavorável
ocorrência da reação é desfavorável
A Energia Livre de Gibbs (G) se torna mínima no equilíbrio se a temperatura e a pressão forem mantidas constantes. Tais condições são obtidas com relativa facilidade. Se a influência de campos magnéticos, elétricos e de outra natureza estiverem presentes e não puderem ser desprezados, então a situação se torna mais complexa.
Finalmente, a energia livre de Helmholtz (A) é fornecida pela seguinte equação
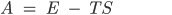 (10.27)
(10.27)
Onde A é a energia livre de Helmholtz, E é a energia interna, T é a temperatura e S é a entropia.
A energia livre de Helmholtz é aplicada em processos a temperatura e volume constantes enquanto a de Gibbs é aplicada a temperatura e pressão constantes. Processos isotérmicos são comuns, porém a inexistência do trabalho (condição isovolumétrica) é uma restrição para a utilização da equação (10.27).
Figura 10.n – Hermann Ludwig Ferdinand von Helmholtz (1821 – 1894)