Um par de elementos puros ou de compostos puros pode ser misturado segundo um número infinito de proporções diferentes. Para cada composição global, o estado de equilíbrio (o número de fases presentes, suas composições e as proporções relativas de cada fase) é uma função da temperatura e da pressão. A maior parte das operações usadas no processamento dos materiais é feita à pressão atmosférica ou a uma pressão próxima desta. Portanto, freqüentemente, a pressão não é uma variável significativa. Nos diagramas considerados neste capítulo a pressão foi fixada em uma atmosfera (1). Já que um grau de liberdade foi usado para se especificar a pressão, a regra das fases passa a ter a forma:
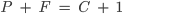 (8.2)
(8.2)
Nos diagramas binários, a temperatura é lançada como ordenada e a composição da liga como abscissa. Como C=2, por definição, o equilíbrio de uma fase apresenta dois graus de liberdade: a temperatura e a composição da fase
 (8.3)
(8.3)
e é representada no diagrama de equilíbrio por uma área ou um “domínio de fase”.
O equilíbrio de duas fases tem um grau de liberdade
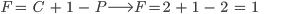 (8.4)
(8.4)
Se a temperatura é especificada, as composições de ambas as fases em equilíbrio estão determinadas. O equilíbrio de duas fases é representado em um diagrama binário por duas curvas temperatura-composição e pela área compreendida entre estas curvas. Por um raciocínio análogo, conclui-se que o equilíbrio de três fases tem o grau de liberdade igual a zero, pois
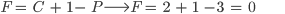 (8.5)
(8.5)
e é representado por um ponto, denominado invariante (2).