Os átomos do grupo V (P, As, Sb, Bi) têm cinco elétrons de valência e tendem a cristalizar-se em camadas atômicas corrugadas, fracamente ligadas entre si. Esse arranjo fornece cada átomo com três vizinhos próximos, em posições que satisfazem ao caráter discreto (1) e à direcionalidade das ligações covalentes (Figura 3.f).
No grupo IV, os elementos C, Si, Ge e Sn são os únicos que têm estruturas cristalinas nas quais todas as ligações que “sustentam” o cristal são covalentes. As ligações são o resultado da superposição dos orbitais híbridos 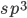 , e a estrutura resultante para o C, Si, Ge e Sn é a estrutura cúbica do diamante (CFC), mostrada na Figura 3.g. Alguns dos elementos do grupo IV podem ter também estruturas nas quais nem todas as ligações que “sustentam” o cristal são covalentes.
, e a estrutura resultante para o C, Si, Ge e Sn é a estrutura cúbica do diamante (CFC), mostrada na Figura 3.g. Alguns dos elementos do grupo IV podem ter também estruturas nas quais nem todas as ligações que “sustentam” o cristal são covalentes.
Figura. 3.f. A estrutura cristalina do arsênio (As), mostrando camadas corrugadas de átomos, referidas a um prisma hexagonal. A célula unitária romboédrica é indicada com linhas grossas e átomos mais escuros. As posições atômicas são representadas por esferas e as ligações direcionais por hastes entre esferas. A coordenação atômica é tripla.
Figura 3.g- A estrutura cúbica do diamante. As posições atômicas são representadas por esferas e as ligações direcionais por hastes entre as esferas. As posições das esferas claras mostram que a estrutura cúbica do diamante é uma rede CFC com dois átomos por ponto da rede. Nesta figura, os dois tipos de átomos, com diferentes arredores, são representados por esferas claras (nos pontos da rede CFC na célula unitária) e por esferas de coloridas (coordenadas tetraedricamente pelas esferas claras, e situadas no interior da célula). Os planos diagonais, nos quais os átomos de carbono aparecem mais espaçados, são os planos de clivagem do diamante.