Freqüentemente, as estruturas cristalinas complexas resultantes de ligações de várias espécies de átomos podem ser entendidas mais facilmente se os cristais forem considerados como poliedros de coordenação, e as subunidades, ou moléculas, feitas com esses poliedros. Como exemplo, vamos considerar os silicatos.
A unidade estrutural básica dos silicatos é o tetraedro 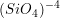 (Figura 3.v). A ligação Si—O é parcialmente covalente(1). A coordenação tetraédrica satisfaz às exigências de ligação, tanto de direcionalidade da covalência, quanto em relação à razão dos tamanhos dos íons (VEJA TABELA 2.1, Tópico 3, Capítulo 2), entre
(Figura 3.v). A ligação Si—O é parcialmente covalente(1). A coordenação tetraédrica satisfaz às exigências de ligação, tanto de direcionalidade da covalência, quanto em relação à razão dos tamanhos dos íons (VEJA TABELA 2.1, Tópico 3, Capítulo 2), entre 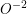 (140 picometros (2)) e
(140 picometros (2)) e 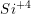 (40 picometros). A variedade de estruturas dos silicatos é devida às várias combinações possíveis desses tetraedros, não só entre si como também com outros íons. Por causa da elevada carga do íon
(40 picometros). A variedade de estruturas dos silicatos é devida às várias combinações possíveis desses tetraedros, não só entre si como também com outros íons. Por causa da elevada carga do íon 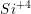 e seu baixo Número de Coordenação (NC) (3), as unidades tetraédricas
e seu baixo Número de Coordenação (NC) (3), as unidades tetraédricas 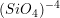 raramente se unem aresta a aresta e nunca face a face.
raramente se unem aresta a aresta e nunca face a face.
Os cristais obtidos quando os tetraedros não se unem entre si, mas sim a cátions na estrutura cristalina, são chamados de silicatos isolados ou ortosilicatos. Dois grupos conhecidos de gemas naturais são as granadas e as olivinas(4). As fórmulas destes e de outros silicatos são apresentadas na Tabela 3.2. O arranjo do silicato isolado no grupo das olivinas 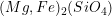 (5) é tal que os átomos de oxigênio formam uma estrutura HC distorcida, com os átomos de silício preenchendo um oitavo das posições catiônicas tetraédricas. Os átomos de magnésio ou ferro preenchem então a metade das posições catiônicas octaédricas. Em 2004, dois robôs norte-americanos descobriram olivinas e granadas no solo do planeta Marte. Outro exemplo muito conhecido de ortosilicato é o Zircão (ou Zirconita), fórmula
(5) é tal que os átomos de oxigênio formam uma estrutura HC distorcida, com os átomos de silício preenchendo um oitavo das posições catiônicas tetraédricas. Os átomos de magnésio ou ferro preenchem então a metade das posições catiônicas octaédricas. Em 2004, dois robôs norte-americanos descobriram olivinas e granadas no solo do planeta Marte. Outro exemplo muito conhecido de ortosilicato é o Zircão (ou Zirconita), fórmula 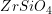 .
.
Se dois vértices de cada tetraedro são compartilhados com outros tetraedros, o resultado é uma “cadeia simples” de tetraedros ligados pelo vértice ou um “anel” construído com tetraedros 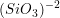 ligados pelo vértice. A enstatita,
ligados pelo vértice. A enstatita, 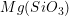 , é um exemplo de um silicato de cadeia simples. A estrutura do mineral berilo,
, é um exemplo de um silicato de cadeia simples. A estrutura do mineral berilo, 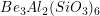 , é um anel.
, é um anel.
Os arranjos dos tetraedros, numa cadeia simples e das cadeias simples para o cristal, são mostrados na Figura 3.v.
Planos de clivagem (plano ao longo do qual o cristal se parte com facilidade) em silicatos de cadeias simples interceptam-se segundo ângulos específicos (87° e 93°), porque é bem mais fácil romper as ligações iônicas entre as camadas de silicato (ligadas entre si por íons positivos) do que quebrar as ligações covalentes Si-O.
Figura 3.v- (a) Tetraedro de sílica. (b) O arranjo dos tetraedros do silicato numa cadeia de um silicato de cadeia simples. (c) Vista da extremidade de uma cadeia simples, mostrando-se a seção transversal aproximadamente trapezoidal. (d) O arranjo de cadeias simples num cristal, mostrando-se os ângulos de interseção de planos de clivagem.
Tabela 3.2. Exemplos de silicatos e suas fórmulas químicas.