Deve ser feita uma distinção entre a termodinâmica de uma reação e a velocidade de uma reação. A termodinâmica de uma reação informa unicamente sobre a possibilidade de ocorrência de uma reação e qual será o estado de equilíbrio, ao passo que a velocidade de uma reação informa sobre a rapidez ou a lentidão de uma reação e qual é o tempo necessário para que o sistema se aproxime do estado de equilíbrio. Um sistema químico é dito estar em equilíbrio se ele não for suscetível de variações espontâneas. Para temperatura e pressão constantes, a variação espontânea ocorrerá quando houver um decréscimo da energia livre do sistema, ou seja, quando 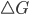 for negativo; esse decréscimo da energia livre do sistema é denominado força motriz de uma reação. Se
for negativo; esse decréscimo da energia livre do sistema é denominado força motriz de uma reação. Se 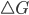 for positivo, a reação pode acontecer apenas na direção oposta. Quando um sistema químico está em equilíbrio, sob condições de temperatura e pressão constantes,
for positivo, a reação pode acontecer apenas na direção oposta. Quando um sistema químico está em equilíbrio, sob condições de temperatura e pressão constantes, 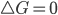 para a reação, e a energia livre total será mínima. Como a energia livre é calculada usando-se tanto a entalpia como a entropia, estas duas grandezas devem ser consideradas no estudo de qualquer processo real.
para a reação, e a energia livre total será mínima. Como a energia livre é calculada usando-se tanto a entalpia como a entropia, estas duas grandezas devem ser consideradas no estudo de qualquer processo real.
A importância da temperatura na determinação das velocidades das reações pode ser descrita considerando a seguinte reação hipotética, entre duas espécies gasosas, em temperatura constante:
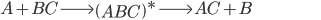 (13.6)
(13.6)
Para ocorrer a reação representada pela Eq. (13.6), o elemento 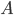 deve colidir com a molécula
deve colidir com a molécula  , com energia cinética suficiente para quebrar a ligação
, com energia cinética suficiente para quebrar a ligação 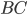 e permitir a formação da molécula
e permitir a formação da molécula  . O estado intermediário
. O estado intermediário 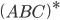 , que só existe por aproximadamente
, que só existe por aproximadamente 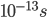 , é denominado complexo ativado. O complexo ativado apresenta uma energia mais alta que o elemento
, é denominado complexo ativado. O complexo ativado apresenta uma energia mais alta que o elemento 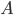 e a molécula
e a molécula 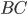 originais. Esse aumento de energia, chamado de entalpia de ativação
originais. Esse aumento de energia, chamado de entalpia de ativação 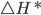 , representa exatamente a energia necessária para quebrar as ligações na molécula
, representa exatamente a energia necessária para quebrar as ligações na molécula 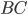 e formar o complexo ativado, que se decompõe, posteriormente nos produtos
e formar o complexo ativado, que se decompõe, posteriormente nos produtos 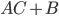 . Contudo, apenas uma pequena fração dos átomos e moléculas envolvidos possui energia cinética maior ou igual a
. Contudo, apenas uma pequena fração dos átomos e moléculas envolvidos possui energia cinética maior ou igual a 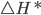 (Veja Figura 13.e). Então, a maioria das colisões entre átomos
(Veja Figura 13.e). Então, a maioria das colisões entre átomos 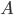 e moléculas
e moléculas 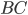 não produzirá a reação representada pela equação (13.6), mas essa fração aumentará significativamente com o aumento da temperatura do gás, de acordo com uma relação do tipo Arrhenius:
não produzirá a reação representada pela equação (13.6), mas essa fração aumentará significativamente com o aumento da temperatura do gás, de acordo com uma relação do tipo Arrhenius:
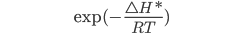 (13.7)
(13.7)
Figura 13.e – Gráfico da distribuição de energia cinética de moléculas gasosas nas temperaturas 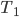 e
e 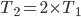 . A fração total de moléculas que possui energias maiores do que uma entalpia de ativação hipotética
. A fração total de moléculas que possui energias maiores do que uma entalpia de ativação hipotética 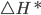 e é dada pela área sobre a curva de
e é dada pela área sobre a curva de 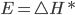 até
até 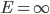 . Observar que a área aumenta muito com o aumento da temperatura.
. Observar que a área aumenta muito com o aumento da temperatura.