Na equação (13.1) a dependência exponencial da velocidade de uma reação com a temperatura foi especificada pela energia de ativação Q e essa dependência se assemelha à da distribuição de Maxwell-Boltzmann (1), que especifica a distribuição de energia das moléculas nos gases. Numa dada temperatura, poucas partículas possuirão energias muito altas ou muito baixas. De fato, a maioria possuirá um energia entre os dois extremos do sistema; esta energia é chamada de energia média. Uma barreira da energia de ativação deve ser vencida para que a reação ocorra. A relação de Maxwell-Boltzmann expressa a probabilidade de se encontrarem moléculas, por exemplo, com uma energia de um valor 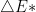 acima da energia média, a uma determinada temperatura T, conforme a expressão:
acima da energia média, a uma determinada temperatura T, conforme a expressão:
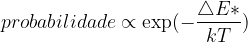 . (13.5)
. (13.5)
O termo  é a energia (ou barreira) de ativação (expressa em unidades de energia por molécula) e k é a constante de Boltzmann ou constante molecular dos gases (expressa em unidades de energia/molécula/ K).
é a energia (ou barreira) de ativação (expressa em unidades de energia por molécula) e k é a constante de Boltzmann ou constante molecular dos gases (expressa em unidades de energia/molécula/ K).
A semelhança existente entre a equação 13.1 (equação de Arrhenius) e a Eq. (13.5) (relação de Boltzmann) sugere que a velocidade de uma reação depende do número de espécies reagentes que possuam uma quantidade de energia 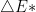 maior que a energia média dos reagentes
maior que a energia média dos reagentes 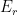 . A Figura 13.c apresenta uma curva que representa a energia de uma única espécie reagente, à medida que caminha ao longo da coordenada de reação; as energias dos reagentes
. A Figura 13.c apresenta uma curva que representa a energia de uma única espécie reagente, à medida que caminha ao longo da coordenada de reação; as energias dos reagentes  e produtos
e produtos 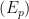 também estão ilustradas na Figura 13.c. A unidade de qualquer reação (ou transformação) pode ser considerada como a coordenada da reação e a energia do sistema pode ser expressa em função da posição da coordenada da reação. A velocidade com que a espécie reagente da Figura 13.c passa pela barreira de ativação é determinada pela altura da barreira da esquerda para a direita e pela fonte de energia disponível para a espécie reagente. Se somente a energia térmica estiver disponível, a equação (13.5) pode ser utilizada para representar a probabilidade de a espécie reagente adquirir
também estão ilustradas na Figura 13.c. A unidade de qualquer reação (ou transformação) pode ser considerada como a coordenada da reação e a energia do sistema pode ser expressa em função da posição da coordenada da reação. A velocidade com que a espécie reagente da Figura 13.c passa pela barreira de ativação é determinada pela altura da barreira da esquerda para a direita e pela fonte de energia disponível para a espécie reagente. Se somente a energia térmica estiver disponível, a equação (13.5) pode ser utilizada para representar a probabilidade de a espécie reagente adquirir 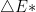 e ultrapassar a barreira de ativação.
e ultrapassar a barreira de ativação.
Figura 13.c – Gráfico qualitativo da energia dos reagentes e dos produtos.  é a barreira energética.
é a barreira energética.