Em Física, o movimento é explicado pelo conceito de força. Em Química, qual seria a força motriz para que reações ocorram e para que elas parem em determinada etapa? O conceito de energia livre ou energia disponível, proposto inicialmente por W. Gibbs (1) em 1883, tem este objetivo.
Também na Física, um mínimo na função energia potencial representa posições de equilíbrio. De modo análogo, o “potencial termodinâmico” passará por um mínimo (equilíbrio termodinâmico) quando a energia livre (G) passar por um mínimo. Esta energia livre ou disponível é a energia que o sistema tem para realizar trabalho. Clausius mostrou que a outra parte da energia do sistema que poderia realizar trabalho não é utilizada porque é gasta nas colisões das moléculas entre si, é gasta em desordem do sistema. Esta energia gasta na desordem, Clausius chamou de entropia (S) (Veja Tópico 10.7).
Em 1882, Helmholtz formulou um conceito de energia livre, parecido com o de Gibbs, e observou que a energia livre é a máxima quantidade de energia disponível para realizar trabalho. As deduções que serão feitas para a energia livre de Gibbs (G), a seguir, são as mesmas que podem ser feitas para a energia livre (A) (3) de Helmholtz. A diferença essencial é que a energia livre de Helmholtz (A) contém em sua equação o termo energia interna (E) (2), enquanto que a energia livre de Gibbs (G) contém o termo entalpia (H).
A energia livre de Gibbs (G) é definida como
 (10.20)
(10.20)
Onde G é a energia livre, H é a entalpia, T é a temperatura e S é a entropia. Sabemos também que H=E+PV (Veja Tópico 10.4) e então
 (10.21)
(10.21)
Podemos estudar esta equação e verificar seus mínimos e máximos. Para isto devemos diferenciar a equação acima
 (10.22)
(10.22)
Lembrando que dE=dQ-dW e que  (Veja Tópico10.7), teremos
(Veja Tópico10.7), teremos
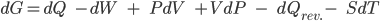 (10.23)
(10.23)
Considerando que dW=PdV, a equação se reduz a
 (10.24)
(10.24)
Gibbs considerou situações onde a pressão e a temperatura são constantes
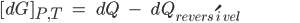 (10.25)
(10.25)
de acordo com segunda lei (Veja Tópico 10.7), a máxima quantidade de calor Q ocorre na transformação reversível
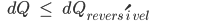
Portanto
 (10.26)
(10.26)
Figura 10.m – Publicação de Williard Gibbs intitulada Um Método para Representação Geométrica das Propriedades Termodinâmicas das Substâncias (1873): o gráfico da energia interna em função da entropia. O ponto A representa o estado inicial do sistema. AD e AE são, respectivamente, a energia e a entropia do sistema no estado inicial. Os segmentos AB e AC representam a energia livre de Gibbs (G) e a capacidade de entropia (S) do sistema, respectivamente. A capacidade de entropia é o incremento de entropia que o sistema pode atingir sem alterar sua energia e volume.