As estruturas ressonantes para o HF (ácido fluorídrico) são:
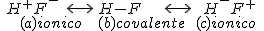
Se os arranjos (a) e (c) contribuem da mesma forma para a molécula híbrida ressonante, então pode-se considerar que HF é uma molécula apolar. Entretanto, HF é uma estrutura polar com a estrutura de tipo (a) predominando sobre a estrutura de tipo (c). Quer dizer, o átomo de flúor (F) atrai preferencialmente os elétrons, em comparação com o átomo de hidrogênio (H). Este aspecto pode ser quantificado através da introdução do conceito de eletronegatividade.
Eletronegatividade é a capacidade de um átomo, de uma molécula ou de um sólido de atrair elétrons ligantes para si. A natureza polar da molécula de HF indica que o átomo de flúor possui uma eletronegatividade maior que a do átomo de hidrogênio.
Se a ligação no HF fosse covalente, seria então plausível esperar que a energia de ligação fosse
 [1.7]
[1.7]
Em outras palavras, o valor da ligação covalente no HF seria igual à metade da soma do valor das energias de ligação H-H e F-F. Este valor é igual a 295 kJ/mol (Veja valores na Tabela 1.3, Tópico 1.6, Ligação Covalente). O valor medido é da ordem de 560 kJ/mol. Esta diferença é devido à maior estabilidade, graças à ressonância e à desigualdade na divisão do compartilhamento de elétrons.
Por outro lado, a energia de ligação do HI (295 kJ/mol) (1) é apenas um pouco maior do que a média da soma das ligações H-H e I-I (292 kJ/mol) e, então,  é pequeno. Estudos empíricos mostraram que, quanto maior é o valor de
é pequeno. Estudos empíricos mostraram que, quanto maior é o valor de  , maior é a desigualdade no compartilhamento do elétron de ligação. Linus Pauling (2) sugeriu a seguinte regra:
, maior é a desigualdade no compartilhamento do elétron de ligação. Linus Pauling (2) sugeriu a seguinte regra:
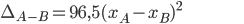 [1.8]
[1.8]
onde 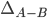 é o excesso de energia de ligação (em kJ/mol de ligações) e
é o excesso de energia de ligação (em kJ/mol de ligações) e 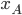 e
e 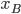 são as eletronegatividades de A e B.
são as eletronegatividades de A e B.
Pauling e outros pesquisadores desenvolveram uma escala empírica de eletronegatividades relativas, como pode ser visto na Figura 1.j.1.(Veja ainda Tabela Períodica, Anexo I deste livro). Com estes valores e com o conhecimento dos valores das energias de ligação, pode-se prever a energia de ligação do composto através da equação empírica
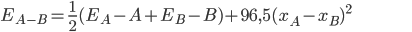 [1.9]
[1.9]
Os valores obtidos com essa equação são aproximados porque a eletronegatividade de um átomo depende da ligação específica em que o átomo está envolvido.
Figura 1.j.1. – Escala empírica de eletronegatividades relativas